题目内容
15.盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示: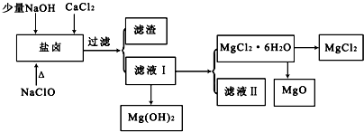
(1)从MgCl2溶液得到MgCl2•6H2O晶体的过程中所需的基本操作顺序依次为BCE;
A.加热蒸馏B.加热浓缩C.冷却结晶D.趁热过滤 E.过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是防止Mg2+水解,Mg2++2H2O?Mg(OH)2+2H+(用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O;加入NaClO的另一个作用是氧化Fe2+使它变成Fe(OH)3沉淀而除去.
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料.
已知25℃时Ksp[Mg(OH)2]=5.6×10-12,且Mg(OH)2(s)═MgO(s)+H2O (s)△H=+81.5kJ/mol.
①下列叙述正确的是B.
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
分析 盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,向盐卤溶液中加入少量NaOH、CaCl2、NaClO溶液并调节溶液的pH,发生的反应分别为Fe3++3OH-=Fe(OH)3、SO42-+Ca2+=CaSO4、3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,次氯钠还能氧化亚铁离子生成铁离子而转化为氢氧化铁沉淀,然后过滤,得到的滤渣中含有Fe(OH)2、Fe(OH)3、CaSO4,滤液中含有氯化镁,向滤液I中加入碱然后过滤得到Mg(OH)2沉淀和MgCl2溶液,将溶液蒸发浓缩、冷却结晶得到MgCl2.6H2O,在HCl氛围中加入MgCl2.6H2O得到MgCl2、MgO,
(1)从MgCl2溶液得到MgCl2•6H2O蒸发浓缩、冷却结晶、过滤洗涤;
(2)氯化镁易水解生成氢氧化镁和HCl,升高温度促进盐酸挥发,促进氯化镁水解;
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,应该生成氮气、二氧化碳和水,根据反应物和生成物书写方程式;
加入NaClO还能氧化还原性离子;
(4)①A.从盐卤或海水中获得Mg(OH)2,工业上选择石灰乳作沉淀剂,NaOH价格较高;
B.Mg(OH)2受热分解生成MgO,MgO熔点较高;
C.电解熔融的MgCl2冶炼制金属镁;
②25℃时,在Mg(OH)2的饱和溶液中c(OH-)=$\root{3}{2{K}_{sp}}$=$\root{3}{2×5.6×1{0}^{-12}}$mol/L,
该溶液中c(H+)=$\frac{1{0}^{-14}}{\root{3}{2×5.6×1{0}^{-12}}}$mol/L,溶液的pH=-lg$\frac{1{0}^{-14}}{\root{3}{2×5.6×1{0}^{-12}}}$≈10.3.
解答 解:盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,向盐卤溶液中加入少量NaOH、CaCl2、NaClO溶液并调节溶液的pH,发生的反应分别为Fe3++3OH-=Fe(OH)3、SO42-+Ca2+=CaSO4、3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,次氯钠还能氧化亚铁离子生成铁离子而转化为氢氧化铁沉淀,然后过滤,得到的滤渣中含有Fe(OH)2、Fe(OH)3、CaSO4,滤液中含有氯化镁,向滤液I中加入碱然后过滤得到Mg(OH)2沉淀和MgCl2溶液,将溶液蒸发浓缩、冷却结晶得到MgCl2.6H2O,在HCl氛围中加入MgCl2.6H2O得到MgCl2、MgO,
(1)从MgCl2溶液得到MgCl2•6H2O蒸发浓缩、冷却结晶、过滤洗涤,故选BCE;
(2)氯化镁易水解生成氢氧化镁和HCl,升高温度促进盐酸挥发,促进氯化镁水解,为抑制氯化镁水解,需要在HCl氛围中加热,故答案为:防止Mg2+水解,Mg2++2H2O?Mg(OH)2+2H+;
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,应该生成氮气、二氧化碳和水,根据反应物和生成物书写方程式为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O;
加入NaClO还能氧化还原性离子亚铁离子,使它变成Fe(OH)3沉淀而除去,
故答案为:3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O;氧化Fe2+使它变成Fe(OH)3沉淀而除去;
(4)①A.从盐卤或海水中获得Mg(OH)2,NaOH价格较高,工业上选择石灰乳作沉淀剂而不是NaOH,故A错误;
B.Mg(OH)2受热分解生成MgO且该反应是吸热反应,MgO熔点较高,一般条件下不熔融,所以Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物,故正确;
C.电解熔融的MgCl2冶炼制金属镁,因为MgO熔点高,电解熔融MgO冶炼Mg需要消耗大量能源,故错误;
故选B;
②25℃时,在Mg(OH)2的饱和溶液中c(OH-)=$\root{3}{2{K}_{sp}}$=$\root{3}{2×5.6×1{0}^{-12}}$mol/L,
该溶液中c(H+)=$\frac{1{0}^{-14}}{\root{3}{2×5.6×1{0}^{-12}}}$mol/L,溶液的pH=-lg$\frac{1{0}^{-14}}{\root{3}{2×5.6×1{0}^{-12}}}$≈10.3,根据表中数据知,该溶液呈蓝色,故答案为:蓝色.
点评 本题考查物质制备,为高频考点,侧重考查学生分析、计算及知识综合运用能力,明确难溶物溶解平衡、盐类水解、金属冶炼、氧化还原反应等知识点是解本题关键,难点是(4)溶液溶液pH值的计算,注意:金属Mg冶炼采用电解熔融氯化镁的方法,而Al采用电解熔融氧化铝的方法冶炼,题目难度不大.

| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
| A. | NH4+和OH- | B. | HS-与S2- | C. | CO和N2 | D. | H2O2和K+ |
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
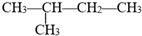 用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.
用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.