题目内容
20.过氧化钠具有强氧化性,氢气具有强还原性,有同学认为二者能发生反应.拟通过实验探究过氧化钠与氢气是否发生反应并检验其反应产物,设计的实验装置如图所示.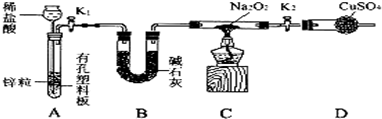
回答下列问题.
(1)盛装CuSO4的仪器名称为干燥管.
(2)组装好仪器,装入药品前,需要进行的操作是检查装置气密性.
(3)从长颈漏斗中加入稀盐酸时,发现难以加入,可能的原因是开关K1未打开.
(4)装置B的作用是除去氢气中的氯化氢和水蒸气,点燃装置C中的酒精灯之前需要进行的操作是检验氢气的纯度.
(5)加热后观察到硬质玻璃管内过氧化钠开始熔化,淡黄色固体逐渐变成白色,无水CuSO4粉末开始变蓝色.根据实验现象可推断装置C试管中发生反应的化学方程式为Na2O2+H2=Na2O+H2O.
分析 为推测Na2O2与H2能反应,首选要制得氢气,A为氢气的制备装置,实验室用锌与稀盐酸反应制氢气,制得的氢气中含氯化氢气体、水蒸气,用B碱石灰吸收,C是Na2O2与H2的反应装置,D检验其产物是否有水生成.
(1)结合图象和实验室常见仪器名称分析判断;
(2)实验过程中是气体发生的反应,装入药品前,需要进行的操作是检查装置气密性;
(3)长颈漏斗中加入稀盐酸时,发现难以加入可能是开关K1未打开;
(4)B装置的作用是:除去氢气中的氯化氢和水蒸气或除杂,氢气不纯易爆炸;
(5)加热后观察到硬质玻璃管内过氧化钠开始熔化,淡黄色固体逐渐变成白色,无水CuSO4粉末开始变蓝色,说明生成水蒸气,结合原子守恒写出白色固体为氧化钠.
解答 解:为推测Na2O2与H2能反应,首选要制得氢气,A为氢气的制备装置,实验室用锌与稀盐酸反应制氢气,制得的氢气中含氯化氢气体、水蒸气,用B碱石灰吸收,C是Na2O2与H2的反应装置,D检验其产物是否有水生成,
(1)盛装CuSO4的仪器名称为干燥管,
故答案为:干燥管;
(2)实验过程中是气体发生的反应,装入药品前,需要进行的操作是检查装置气密性,防止装置漏气,
故答案为:检查装置气密性;
(3)从长颈漏斗中加入稀盐酸时,发现难以加入,说明装置A中气体增大后液体不能流下,可能的原因是开关K1未打开,
故答案为:开关K1未打开;
(4)装置A中锌和稀盐酸反应生成的氢气中含水蒸气和氯化氢杂质气体,装置B的作用是除去氢气中的氯化氢和水蒸气,因不纯点燃易爆炸的药品必须进行检验纯度,防止空气与氢气混合加热爆炸,点燃装置C中的酒精灯之前需要进行的操作是检验氢气的纯度,
故答案为:除去氢气中的氯化氢和水蒸气;检验氢气的纯度;
(5)加热后观察到硬质玻璃管内过氧化钠开始熔化,淡黄色固体逐渐变成白色,无水CuSO4粉末开始变蓝色,说明生成水蒸气,结合原子守恒写出白色固体为氧化钠,根据实验现象可推断装置C试管中发生反应的化学方程式为:Na2O2+H2=Na2O+H2O,故答案为:Na2O2+H2=Na2O+H2O.
点评 本题主要考查的是实验室常用仪器以及气密性的检查、硫酸铜的性质、过氧化钠的性质等,题目难度中等.

| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
| A. | c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| B. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| C. | 强酸性溶液中:Fe3+、K+、SCN-、SO42- | |
| D. | 石蕊试液呈紫色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和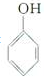 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.