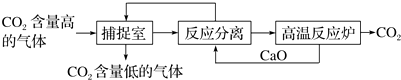
题目内容
5.瓦斯中氧气与甲烷的质量比为4﹕1时极易爆炸,此时氧气与甲烷的体积比为( )| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
分析 依据n=$\frac{m}{M}$=$\frac{V}{Vm}$结合相同条件下,气体的体积之比等于物质的量之比解答.
解答 解:根据阿伏加德罗推论:v(O2):v(CH4)=n(O2):n(CH4)=$\frac{4}{32}$:$\frac{1}{16}$=2:1,
故选:A.
点评 本题考查了有关物质的量计算,熟悉相关计算公式是解题关键,侧重考查学生对基础知识 掌握熟练程度.

练习册系列答案
相关题目
16.下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,
按要求回答下列问题.
(1)化学性质最不活泼的元素是氩(填名称).
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是Na2O2,该化合物呈淡黄色.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的原子最外层电子数为5.
(5)元素⑤的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(6)元素⑦、⑩中,化学性质较不活泼的元素是Br(填元素符号).
(7)元素④的氢化物化学式CH4,元素②的最高价氧化物对应的水化物的化学式Mg(OH)2.
(8)元素③的氢氧化物和稀盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
按要求回答下列问题.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是Na2O2,该化合物呈淡黄色.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的原子最外层电子数为5.
(5)元素⑤的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(6)元素⑦、⑩中,化学性质较不活泼的元素是Br(填元素符号).
(7)元素④的氢化物化学式CH4,元素②的最高价氧化物对应的水化物的化学式Mg(OH)2.
(8)元素③的氢氧化物和稀盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
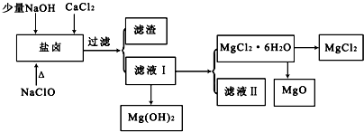
13.某学习小组利用废旧电池拆解后的碳包滤渣(含MnO2、C、Hg2+ 等)制取硫酸锰晶体( MnSO4•H2O ),实验流程如下:
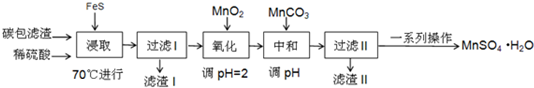
已知:(1)25℃时,几种硫化物的溶度积常数如下:
(2)25℃时,几种金属氢氧化物沉淀时的PH如下:
请回答下列问题:
(1)“浸取”时加热的作用是提高浸取的反应速率;
写出“浸取”时生成MnSO4、Fe2(SO4)3 反应的离子方程式:9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O.
(2)若“浸取”在25℃时进行,加入足量FeS,则FeS(s)+Hg2+(aq)?HgS(s)+Fe2+ (aq)的平衡常数K为2.5×1036.
(3)过滤I过程中,需要使用的玻璃仪器有烧杯、漏斗、玻璃棒,滤渣I的主要成分为FeS、S 和HgS和C(化学式).
(4)“氧化”时加入MnO2 的作用是将Fe2+全部氧化为Fe3+,也可用H2O2 代替MnO2 ,H2O2 的电子式为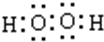 .
.
(5)“中和”过程,应该调节溶液PH为3.7≤PH<8.3,写出该过程产生滤渣II的离子方程式:2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑
(6)获得MnSO4•H2O的“一系列操作”是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)1150℃时,MnSO4•H2O 在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物等,分解反应的化学方程式是:3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20,在MnSO4•H2O进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有坩埚、泥三角.

已知:(1)25℃时,几种硫化物的溶度积常数如下:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
(1)“浸取”时加热的作用是提高浸取的反应速率;
写出“浸取”时生成MnSO4、Fe2(SO4)3 反应的离子方程式:9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O.
(2)若“浸取”在25℃时进行,加入足量FeS,则FeS(s)+Hg2+(aq)?HgS(s)+Fe2+ (aq)的平衡常数K为2.5×1036.
(3)过滤I过程中,需要使用的玻璃仪器有烧杯、漏斗、玻璃棒,滤渣I的主要成分为FeS、S 和HgS和C(化学式).
(4)“氧化”时加入MnO2 的作用是将Fe2+全部氧化为Fe3+,也可用H2O2 代替MnO2 ,H2O2 的电子式为
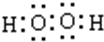 .
.(5)“中和”过程,应该调节溶液PH为3.7≤PH<8.3,写出该过程产生滤渣II的离子方程式:2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑
(6)获得MnSO4•H2O的“一系列操作”是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)1150℃时,MnSO4•H2O 在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物等,分解反应的化学方程式是:3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20,在MnSO4•H2O进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有坩埚、泥三角.
20.下列说法不正确的是( )
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
14.表是元素周期表的一部分,用 化学式回答下列问题
(1)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar,除稀有气体外,原子半径最大的是K.
(2)所有元素的最高价氧化物对应的水化物中酸性最强的 物质是HClO4,碱性最强的 物质是KOH.
(3)③的最高价氧化物对应水化物的电子式为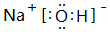 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(4)请说出③的金属性比④强的一个科学事实NaOH溶液碱性比Mg(OH)2强.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)所有元素的最高价氧化物对应的水化物中酸性最强的 物质是HClO4,碱性最强的 物质是KOH.
(3)③的最高价氧化物对应水化物的电子式为
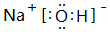 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O(4)请说出③的金属性比④强的一个科学事实NaOH溶液碱性比Mg(OH)2强.
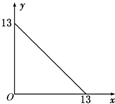 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题: