题目内容
2.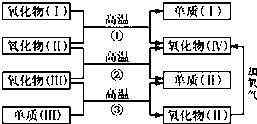 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应:其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体.
(1)氧化物(Ⅰ)的化学式(分子式)是Fe2O3;氧化物(Ⅱ)的化学式是CO.
(2)反应①的化学方程式是Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;反应②的化学方程式是CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2.
分析 氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3,由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(Ⅱ)为H2;由于氧化物(Ⅲ)即CO和单质(Ⅲ)在高温条件下生成H2和CO,故单质(Ⅲ)为C,据此解答.
解答 解:氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3,由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(Ⅱ)为H2;由于氧化物(Ⅲ)即CO和单质(Ⅲ)在高温条件下生成H2和CO,故单质(Ⅲ)为C.
(1)氧化物(Ⅰ)的化学式是Fe2O3,氧化物(Ⅱ)的化学式是CO,故答案为:Fe2O3,CO;
(2)反应①是Fe2O3与CO在高温条件下发生氧化还原反应生成Fe和CO2,化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
反应②是CO和H2O在高温条件下生成CO2和H2,化学方程式为:CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2.
点评 本题考查考查无机物推断,氧化物(Ⅰ)是红棕色固体是本题的突破口,难度不大,熟练掌握常见元素单质化合物性质.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
12.下列依据热化学方程式得出的结论不正确的是( )
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |
13.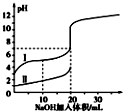 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
17.植物在遇到干旱、洪涝、低温、病虫害等情况下会产生有强氧化性的活性氧(即原子态氧),它能导致植物生长缓慢或死亡.朝鲜科学家根据这一原理于2001年1月成功开发出能排除活性氧的植物苏醒剂,提高植物抗旱、涝等的能力.下列关于植物苏醒剂的说法正确的是( )
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
7.下列变化不能通过一步反应直接完成的是( )
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
14.下列反应中的氨与反应4NH3+5O2→4NO+6H2O中的氨作用不相同的是( )
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
11.在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,下列判断正确的是( )
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
16.金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+.下列说法正确的是( )
| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
 ②
② ③
③ ④TNT
④TNT