题目内容
7.下列变化不能通过一步反应直接完成的是( )| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
分析 A.Al能与NaOH反应;
B.碳酸钠与氢氧化钙反应;
C.氧化铝不溶于水,与水不反应;
D.氢氧化亚铁易被氧化.
解答 解:A.Al$\stackrel{NaOH、H_{2}O}{→}$[Al(OH)4]-,可一步转化,故A不选;
B.Na2CO3$\stackrel{Ca(OH)_{2}}{→}$NaOH,可一步转化,故B不选;
C.Al2O3→Al(OH)3不能一步完成,故C选;
D.Fe(OH)2$\stackrel{O_{2}、H_{2}O}{→}$Fe(OH)3,可一步转化,故D不选;
故选C.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力考查,题目难度不大.

练习册系列答案
相关题目
18.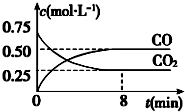 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
(1)该反应的平衡常数表达式 K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)能表明反应一定处于平衡状态的是AB(填序号).
A.固体总质量保持不变 B.气体密度不变
C.v正(Fe)=v逆(FeO) D.CO2与CO浓度相等
(3)8min 内,CO的平均反应速率v(CO)=0.0625 mol•L-1•min-1
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①下列说法正确的是BC.
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求 c1=0.67mol•L-1、φ1=33.3%、α2=33.3%.
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式 K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)能表明反应一定处于平衡状态的是AB(填序号).
A.固体总质量保持不变 B.气体密度不变
C.v正(Fe)=v逆(FeO) D.CO2与CO浓度相等
(3)8min 内,CO的平均反应速率v(CO)=0.0625 mol•L-1•min-1
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求 c1=0.67mol•L-1、φ1=33.3%、α2=33.3%.
12.实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液,以下仪器中不需要用到的是( )
| A. | 烧杯 | B. | 玻璃棒 | C. | 容量瓶 | D. | 分液漏斗 |
19.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol/L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是( )
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
16.某乙酸乙酯(CH3C18OOCH2CH3),它在酸性水中充分水解后,可以检测到含有18O的分子是( )
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
1.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
①列式并计算平衡常数K=$\frac{2}{3}$.
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
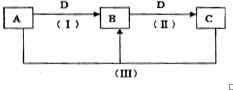 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题: .
.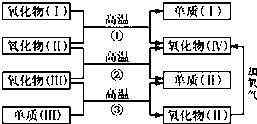 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应: