题目内容
17.植物在遇到干旱、洪涝、低温、病虫害等情况下会产生有强氧化性的活性氧(即原子态氧),它能导致植物生长缓慢或死亡.朝鲜科学家根据这一原理于2001年1月成功开发出能排除活性氧的植物苏醒剂,提高植物抗旱、涝等的能力.下列关于植物苏醒剂的说法正确的是( )| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
分析 由题给信息可知加入植物苏醒剂应起到抗氧化剂的作用,应具有还原性,以此解答.
解答 解:植物在遇到干旱、洪涝、低温、病虫害等情况下会产生有强氧化性的活性氧而导致植物死亡,但是加入植物苏醒剂能能排除活性氧,说明植物苏醒剂起到还原剂的作用,故选B.
点评 本题考查氧化还原反应,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习学习的积极性,注意把握题给信息,难度不大.

练习册系列答案
相关题目
5.利用已有的实验器材,规格和数量不限,能完成相应实验的是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| A. | A | B. | B | C. | C | D. | D |
9.若丙醇中的氧原子为18O,它和乙酸反应生成的酯的相对分子质量为( )
| A. | 102 | B. | 104 | C. | 120 | D. | 122 |
6.有机物A可以发生下列反应:

已知C的相对分子质量为46,E不能与新制的氢氧化铜反应.则有机物A的可能结构有( )

已知C的相对分子质量为46,E不能与新制的氢氧化铜反应.则有机物A的可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
11. 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | | |
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
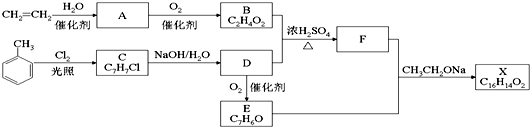
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ .B和D反应生成F的化学方程式
.B和D反应生成F的化学方程式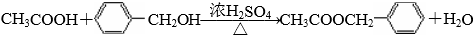 .D→E的化学方程式2
.D→E的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. .
. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.
COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.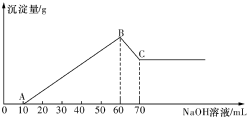 有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验:
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子.现分别取溶液进行下列实验: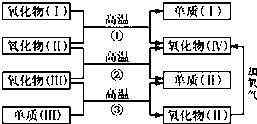 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应: