题目内容
13.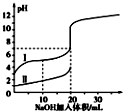 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
分析 A.相同浓度的醋酸和盐酸,醋酸电离程度小于盐酸,导致未滴加NaOH时pH:HCl<CH3COOH;
B.pH=7时,溶液中c(H+)=10-7mol/L,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$;
C.V(NaOH)=10.00 mL 时,醋酸溶液中溶质为醋酸钠和醋酸、盐酸溶液中溶质为NaCl和HCl,盐酸中离子浓度大于醋酸,离子浓度越大溶液导电能力越强;
D.向盐酸中加 NaOH 至 pH=12 时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L=$\frac{0.100mol/L×VmL-0.100mol/L×20.00mL}{(V+20.00)mL}$,据此计算V(NaOH).
解答 解:A.相同浓度的醋酸和盐酸,醋酸电离程度小于盐酸,导致未滴加NaOH时pH:HCl<CH3COOH,根据图知Ⅰ、Ⅱ分别表示醋酸和盐酸的反应曲线,故A错误;
B.pH=7时,溶液中c(H+)=10-7mol/L,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$=$\frac{1.7×1{0}^{-5}}{1{0}^{-7}}$=170,故B正确;
C.V(NaOH)=10.00 mL 时,醋酸溶液中溶质为醋酸钠和醋酸、盐酸溶液中溶质为NaCl和HCl,盐酸中离子浓度大于醋酸,离子浓度越大溶液导电能力越强,所以盐酸溶液导电能力强,故C错误;
D.向盐酸中加 NaOH 至 pH=12 时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L=$\frac{0.100mol/L×VmL-0.100mol/L×20.00mL}{(V+20.00)mL}$,V(NaOH)=$\frac{220}{9}$,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,涉及pH计算、溶液导电性强弱判断、电离平衡常数计算等知识点,侧重考查学生分析判断及计算能力,注意:溶液导电能力与离子浓度及电荷有关,与电解质溶液酸碱性及电解质强弱无关,易错选项是C.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案| A. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1mol•L-1 NaOH溶液中的c(H+),前者大于后者 | |
| D. | 向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去 |
| 已知条件 | 热化学方程式 | |
| A | 中和热为57.3kJ/mol | H2SO4(aq)+Ba(OH)2(aq)═ BaSO4(s)+2H2O(l) △H=-114.6kJ/mol |
| B | 合成氨反应生成0.1mol NH3时放出a kJ热量 | N2(g)+3H2(g)?2NH3(g) △H=-20a kJ/mol |
| C | H2的燃烧热为285.8kJ/mol | H2(g)+$\frac{1}{2}$O2(g)═H2O(g) △H=-285.8kJ/mol |
| D | 碳的燃烧热为393.5kJ/mol | 2C(s)+O2(g)═2CO(g) △H=-787kJ/mol |
| A. | A | B. | B | C. | C | D. | D |
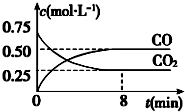 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式 K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)能表明反应一定处于平衡状态的是AB(填序号).
A.固体总质量保持不变 B.气体密度不变
C.v正(Fe)=v逆(FeO) D.CO2与CO浓度相等
(3)8min 内,CO的平均反应速率v(CO)=0.0625 mol•L-1•min-1
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求 c1=0.67mol•L-1、φ1=33.3%、α2=33.3%.
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| A. | A | B. | B | C. | C | D. | D |
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
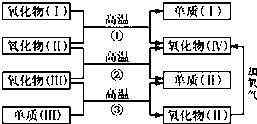 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应: