题目内容
16.金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+.下列说法正确的是( )| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
分析 A.电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce;
B.由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质,具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素同位素;
C.氧化性:Ce4+>Fe3+>I-,不会生成CeI4;
D.元素符号左下角数字为质子数,铈的原子核外有58个电子.
解答 解:A.电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce,电极反应为:Ce4++4e-=Ce,故A错误;
B.58138Ce、58142Ce具有相同质子数,不同中子数,故它们互为同位素,不是同素异形体,故B错误;
C.由于氧化性Ce4+>Fe3+>I-,铈溶于氢碘酸,产物不会生成CeI4,应该是CeI3,故C错误;
D.根据金属铈(58Ce)可知,铈元素的质子数为58,原子中质子数等于核外电子,故铈的原子核外有58个电子数,故D正确;
故选D.
点评 本题考查了金属的冶炼、同素异形体、元素符号的意义等知识,主要是考查分析、利用信息,信息迁移和解决问题的能力,难度中等.

练习册系列答案
相关题目
7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
11. 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度.请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和;
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O△H=-113.68kJ/mol;
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | | |
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)不能(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ.原因是浓硫酸稀释放热.
1.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
①列式并计算平衡常数K=$\frac{2}{3}$.
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)
8.现有H+浓度相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的H+浓度仍相等,则m和n的关系是( )
| A. | m>n | B. | m=n | C. | m<n | D. | 无法确定 |
6.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3.H20═Al02-+4NH4++2H20 | |
| B. | 澄清石灰水与足量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaC03+CO32-+2 H2O | |
| C. | 食醋腐蚀大理石面板:CaCO3+2 H+═Ca2++CO2+H2O | |
| D. | 少量钠投入硫酸铜溶液中:2Na+Cu2+═2 Na++Cu |
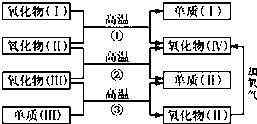 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应: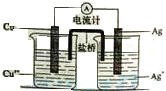 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.