题目内容
11.在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,下列判断正确的是( )| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
分析 恒温、恒压的条件下,只要开始时加入反应物的物质的量之比相等,平衡等效,即达平衡状态时各组分的百分含量相等,据此分析解答.
解答 解:恒温、恒压的条件下,只要开始时加入反应物的物质的量之比相等,平衡等效,即达平衡状态时各组分的百分含量相等.平衡后等比例加入反应物,正反应速率增大后逐渐减小,逆反应速率减小后增大,平衡正向移动,达新的平衡后,SO3的百分含量保持不变,故选D.
点评 本题考查等效平衡,为高频考点,明确等效平衡特点是解本题关键,注意反应环境是恒压还是恒容,题目难度不大.

练习册系列答案
相关题目
19.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol/L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是( )
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
6.有机物A可以发生下列反应:

已知C的相对分子质量为46,E不能与新制的氢氧化铜反应.则有机物A的可能结构有( )

已知C的相对分子质量为46,E不能与新制的氢氧化铜反应.则有机物A的可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
16.某乙酸乙酯(CH3C18OOCH2CH3),它在酸性水中充分水解后,可以检测到含有18O的分子是( )
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
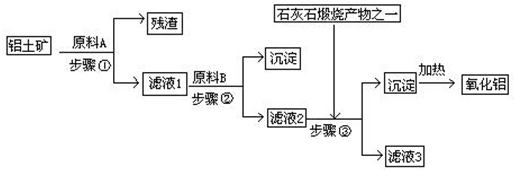
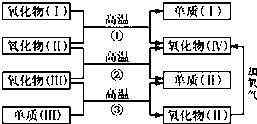 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应: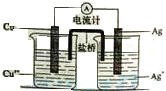 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.