题目内容
17.将标准状况下的HC1气体4.48L溶于水形成100mL溶液,然后与足量的铁屑充分反应,计算:(1)参加反应的铁的质量
(2)生成H2在标准状况的体积.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出HCl的物质的量,再根据方程式计算参加反应的Fe的物质的量,最后根据m=nM计算参加反应的铁的质量;
(2)根据方程式Fe+2HCl=FeCl2+H2↑计算生成的H2的体积(标准状况).
解答 解:(1)标准状况下4.48LHCl气体的物质的量为:n(HCl)=$\frac{4.48L}{22.4L/mol}$=0.2mol,;
Fe+2HCl=FeCl2+H2↑,
1mol 2mol
0.1mol 0.2mol
则参加反应的Fe的质量为:m(Fe)=0.1mol×56g/mol=5.6g,
答:参加反应的铁的质量为5.6g;
(2)Fe+2HCl=FeCl2+H2↑
2mol 22.4L
0.2mol V
则V=$\frac{22.4L×0.2mol}{2mol}$=2.24L,
答:生成H2在标准状况的体积为2.24L.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.下列说法都正确的是( )
| A. | 某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,说明原溶液中一定含SO42- | |
| B. | 将含有SO2杂质的CO2气体,缓慢通过足量的高锰酸钾溶液,再通过浓硫酸干燥,可获得较纯净的CO2气体 | |
| C. | 某钠盐(含NaHCO3、Na2CO3中的一种或两种)试样0.168 g,将其灼烧,冷却,并用托盘天平称量残留固体的质量,根据质量是否变化,可确定样品的组成 | |
| D. | 铝热反应可生成铁,工业上可大量利用该反应来生产铁 |
12.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 碳酸钙与醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| ② | 氢氧化钠溶液中通入CO2 | OH-+CO2=HCO3- | 错误,通往过量CO2应生成CO32- |
| ③ | NaHCO3的水解 | HCO3-+H2O?H2CO3+OH- | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 正确 |
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
9.下列固体,只用水就能区别的是 ( )
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
15.下列物质属于纯净物的是( )
| A. | 苯 | B. | 天然气 | C. | 汽油 | D. | 工业酒精 |
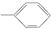 ⑤-CHO.
⑤-CHO.