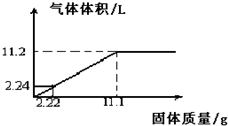
题目内容
9.下列固体,只用水就能区别的是 ( )| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
分析 A.只有碳酸钙不溶于水,NaCl溶于水热效应不明显,NaOH溶于水放热、NH4NO3溶于水吸热;
B.FeCl3溶于水为黄色,CuSO4溶于水为蓝色,Mg(OH)2不溶于水、NaCl溶于水;
C.BaSO4、AgCl均不溶于水;
D.均溶于水得到无色溶液,且热效应不明显.
解答 解:A.只有碳酸钙不溶于水,NaCl溶于水热效应不明显,NaOH溶于水放热、NH4NO3溶于水吸热,利用水可鉴别,故A选;
B.FeCl3溶于水为黄色,CuSO4溶于水为蓝色,Mg(OH)2不溶于水、NaCl溶于水,溶于水现象不同,可鉴别,故B选;
C.BaSO4、AgCl均不溶于水,现象相同,用水不能鉴别,故C不选;
D.均溶于水得到无色溶液,且热效应不明显,现象相同,用水不能鉴别,故D不选;
故选AB.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、溶于水的现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
19.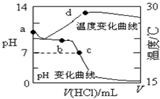 室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点时c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| C. | c点时消耗的盐酸体积:V(HCl)<20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
2.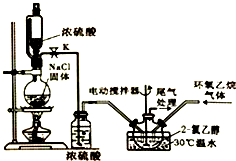 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
反应原理为: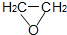 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0
部分实验药品及物理量:
制取与测定实验步骤如下:
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
(1)装置中使用恒压分液漏斗的优点是平衡气压,使分液漏斗内的液体能顺利滴下.
(2)在步骤④中,采用减压分馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解.
(3)写出实验步骤中提高环氧乙烷利用率的措施:氯化氢过量、反应温度控制在30℃.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是cabde.(选填序号)
②操作d加入硝基苯的目的是防止在滴加NH4CSN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则所测样品中Cl元素含量将会偏小.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的C.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为80.50%.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.反应原理为:
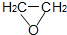 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0部分实验药品及物理量:
| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
(1)装置中使用恒压分液漏斗的优点是平衡气压,使分液漏斗内的液体能顺利滴下.
(2)在步骤④中,采用减压分馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解.
(3)写出实验步骤中提高环氧乙烷利用率的措施:氯化氢过量、反应温度控制在30℃.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是cabde.(选填序号)
②操作d加入硝基苯的目的是防止在滴加NH4CSN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则所测样品中Cl元素含量将会偏小.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的C.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为80.50%.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
9.甲图和乙图分别是1s电子的概率分布图和原子轨道图.下列有关说法正确的是( )

| A. | 甲图中的小黑点疏密表述电子在核外空间出现机会的大小 | |
| B. | 甲图中的每个小黑点表示1个电子 | |
| C. | 乙图表示1s电子只能在球体内出现 | |
| D. | 乙图表明1s轨道呈圆形,有无数对称轴 |