题目内容
2.用惰性电极电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al错误(判断)分析 用惰性电极电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上离子放电顺序Fe3+>Cu2+>H+>Fe2+>Al3+,据此分析解答.
解答 解:用惰性电极电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上离子放电顺序是Fe3+>Cu2+>H+>Fe2+>Al3+,所以阴极上先析出Cu,后生成氢气,不能生成Fe和Al,所以该说法错误,故答案为:错误.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,注意铁离子和铜离子放电先后顺序,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| B. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 常温下,5.6g Fe片投入到足量的浓硝酸中,转移电子数为0.3NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA |
7.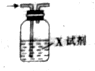 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
 已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )
已知CO2通入澄清石灰水中,溶液先变浑浊,后又变澄清.用如图装置除去CO2气体中的HCl,X试剂最合适的是( )| A. | NaOH溶液 | B. | 浓硫酸 | C. | Na2CO3溶液 | D. | NaHCO3溶液 |
2.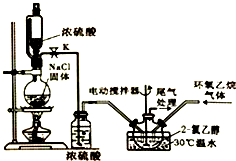 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
反应原理为: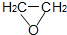 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0
部分实验药品及物理量:
制取与测定实验步骤如下:
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
(1)装置中使用恒压分液漏斗的优点是平衡气压,使分液漏斗内的液体能顺利滴下.
(2)在步骤④中,采用减压分馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解.
(3)写出实验步骤中提高环氧乙烷利用率的措施:氯化氢过量、反应温度控制在30℃.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是cabde.(选填序号)
②操作d加入硝基苯的目的是防止在滴加NH4CSN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则所测样品中Cl元素含量将会偏小.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的C.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为80.50%.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.反应原理为:
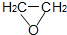 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0部分实验药品及物理量:
| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
(1)装置中使用恒压分液漏斗的优点是平衡气压,使分液漏斗内的液体能顺利滴下.
(2)在步骤④中,采用减压分馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解.
(3)写出实验步骤中提高环氧乙烷利用率的措施:氯化氢过量、反应温度控制在30℃.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是cabde.(选填序号)
②操作d加入硝基苯的目的是防止在滴加NH4CSN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则所测样品中Cl元素含量将会偏小.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的C.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为80.50%.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
19.实验探究是体验知识的产生和形成过程的基本途径.某化学兴趣小组为探究元素性质递变规律,设计了如下实验:
试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
试剂:镁条、铝条、氯水、AlCl3溶液、MgCl2溶液、NaBr溶液、氢硫酸、水、NaOH溶液.请把表格补充完整.
| 实验方案(只要求填写选用试剂) | (1) | (2) |
| AlCl3溶液、MgCl2溶液、NaOH溶液 | 氯水、NaBr溶液 | |
| 实验现象 | 针对方程式①②或③试管中先生成白色沉淀,后白色沉淀消失. 针对方程式④:试管中有白色沉淀. | 溶液由浅黄绿色变成橙黄色 |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO-2+H2O 或③Al3++4OH-═AlO-2+2H2O ④Mg2++2OH-═Mg(OH)2↓ | 2Br-+Cl2═Br2+2Cl- |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
20.下列叙述错误的是( )
| A. | 苯分子中没有碳碳双键 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 乙醇能与金属钠反应,乙酸也能与金属钠反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因相同 |
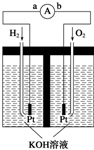 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: