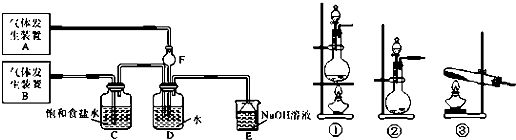
题目内容
13.下列各组中均为两瓶无标签的无色溶液,不许使用其它任何试剂(包括水),也能鉴别出来的是( )①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
分析 不加其他试剂进行鉴别,则首先需要考虑物质的水溶液的颜色,然后物质间相互滴加的顺序不同,产生不同现象进行鉴别,以此解答.
解答 解:①NaOH滴加到Al2(SO4)3溶液中,先有沉淀后沉淀消失,Al2(SO4)3溶液滴加到NaOH溶液中,先无沉淀后生成沉淀,现象不同,可鉴别,故①正确;
②Na2CO3 和稀HCl滴加顺序不同,现象不同:将Na2CO3 滴加到稀HCl中马上有气体产生,但将稀HCl滴加到Na2CO3 溶液中,先没有气体生成,当滴加到一定程度时,才有气体生成,可鉴别,故②正确;
③NaHCO3和盐酸反应生成气体,与量无关,不使用其它试剂不能鉴别,故③错误;
④NaAlO2和稀盐酸,当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,故④正确,
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,把握与量有关的离子反应及相互滴加时发生的化学反应为解答的关键,注意物质的性质差异来鉴别物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | Cl2 | CO2 | CaCl2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl |
| A. | ②③④ | B. | ②③④⑤ | C. | ①③④ | D. | ①③④⑤ |
1.恒温恒容的容器中,建立如下平衡:2A(g)?B(g),在相同条件下,若分别再向容器中通入一定量的A气体,重新达到平衡后,下列说法不正确的是( )
| A. | 平衡向右移动 | B. | A的体积分数比原平衡时小 | ||
| C. | A的转化率增大 | D. | 正反应速率增大,逆反应速率减小 |
18.用下列实验装置进行相应实验,能达到实验目的是( )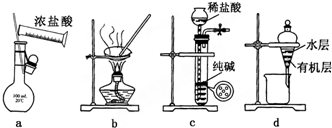

| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
2.能正确表示下列反应的离子方程式为( )
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+H2↑ | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO${\;}_{4}^{-}$+H2O═5VO${\;}_{2}^{+}$+Mn2++2H+ |


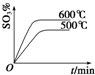
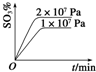
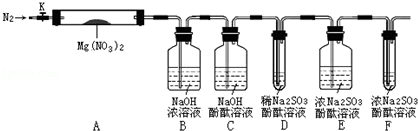
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.