题目内容
1.恒温恒容的容器中,建立如下平衡:2A(g)?B(g),在相同条件下,若分别再向容器中通入一定量的A气体,重新达到平衡后,下列说法不正确的是( )| A. | 平衡向右移动 | B. | A的体积分数比原平衡时小 | ||
| C. | A的转化率增大 | D. | 正反应速率增大,逆反应速率减小 |
分析 保持温度不变,若再向容器中通入一定量的A气体,重新达到的平衡,可以等效为在原平衡的基础上增大压强达到的平衡,平衡向正反应方向移动,据此判断.
解答 解:恒温恒容的容器中,建立如下平衡:2A(g)?B(g),保持温度不变,若再向容器中通入一定量的A气体,重新达到的平衡,可以等效为在原平衡的基础上增大压强达到的平衡,平衡向正反应方向移动,
A.分析可知平衡向右移动,故A正确;
B.通入一定量的A气体重新达到平衡后,平衡向正反应方向移动的A不如A的浓度增大,A的体积分数比原平衡时小,故B正确;
C.平衡向正反应方向移动,A的转化率增大,故C正确;
D.若再向容器中通入一定量的A气体,重新达到的平衡,可以等效为在原平衡的基础上增大压强达到的平衡,压强增大正逆反应速率都增大,故D错误;
故选D.
点评 本题考查等效平衡的有关问题,难度中等,试题侧重能力的考查和训练,有利于培养学生的逻辑思维能力和抽象思维能力,该题的关键是构建平衡建立的途径.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
12.在通常条件下,NO2和SO2可以很容易发生反应生成NO和SO3.现将碳跟浓硫酸共热产生的气体X和碳跟浓硝酸共热产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )

| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 洗气瓶中产生的沉淀是硫酸钡 | |
| C. | 在Z导管出来的气体中无二氧化碳 | |
| D. | 反应一段时间后洗气瓶中溶液的酸性减弱 |
9.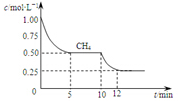 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g);△H=+247.3kJ/mol
③CH4(g)+H2O(g)?3H2(g)+CO(g);△H3
若反应③在1升容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示.下列有关叙述错误的是( )
 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol②CH4(g)+CO2(g)?2CO(g)+2H2(g);△H=+247.3kJ/mol
③CH4(g)+H2O(g)?3H2(g)+CO(g);△H3
若反应③在1升容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示.下列有关叙述错误的是( )
| A. | △H3=+206kJ/mol | |
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
6.下列排列顺序正确的是:
①热稳定性:H2O>HF>H2S ②结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O( )
①热稳定性:H2O>HF>H2S ②结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O( )
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
13.下列各组中均为两瓶无标签的无色溶液,不许使用其它任何试剂(包括水),也能鉴别出来的是( )
①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2.
①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
10.下列图示与对应的叙述相符的是( )
| A. | 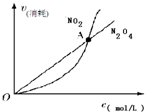 表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 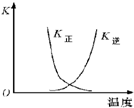 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 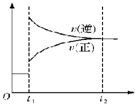 表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 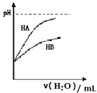 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.