题目内容
2. 锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.
锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.(1)高温锻烧时,闪锌矿(ZnS)与氧气反应生成ZnO和
SO2,其反应方程式为:2ZnS+3O2═2ZnO+2SO2,该反应1mol还原剂失去6mol电子.
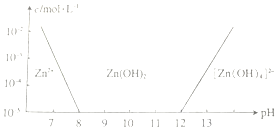
(2)常温下二价锌在水溶液中的存在形式与pH的关系如图所示,横坐标为溶液的pH,纵坐标为Zn2+和[Zn(OH)4]2-的物质的量浓度.已知:当c(Zn2+)=10-5mol•L-1时,Zn2+沉淀完全.由图可以计算得出Zn(OH)2的溶度积常数Ksp=1×10-17.
(3)某锌的化合物的化学式可以表示为aZnCO3•bZn(OH)2•cH2O(a、b、c均为整数).为了确定其组成,先进性如下实验:称取3.85g固体进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,分别增重0.54g和0.88g.通过计算确定该锌的化合物的化学式.(写出计算过程).
分析 (1)由题意书写反应物和生成物,标注化合价,判断氧化剂和还原剂,根据电子守恒配平化学方程式,依据配平的化学方程式计算电子转移总数;
(2)根据图可知,当pH=8时,c(Zn2+)=10-5mol/L,根据Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)计算;
(3)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol、n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,剩余固体为ZnO,n(ZnO)=$\frac{3.85g-0.54g-0.88g}{81g/mol}$=0.03mol,根据原子守恒计算判断其化学式.
解答 解:(1)高温锻烧时,闪锌矿(ZnS)与氧气反应生成ZnO和SO2,根据反应物和生成物和电子守恒书写配平化学方程式,ZnS~SO2~6e-;O2~4e-;最小公倍数为12,所以ZnS前的系数为2,氧气前的系数为3,观察配平化学方程式为2ZnS+3O2═2ZnO+2SO2;1mol还原剂ZnS转移电子为6mol;
故答案为:2ZnS+3O2═2ZnO+2SO2; 6;
(2)根据图可知,当pH=8时,c(Zn2+)=10-5mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-5×(10-6)2=1×10-17,故答案为:1×10-17;
(3)浓硫酸吸收H2O、碱石灰吸收CO2,n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol、n(CO2)=$\frac{0.88g}{44g/mol}$=0.02mol,剩余固体为ZnO,n(ZnO)=$\frac{3.85g-0.54g-0.88g}{81g/mol}$=0.03mol,根据原子守恒得(a+b):a:(b+c)=0.03mol:0.02mol:0.03mol=3:2:3,则a:b:c=2:1:2,所以沉淀的组成为2ZnCO3•Zn(OH)2•2H2O,
答:沉淀的组成为2ZnCO3•Zn(OH)2•2H2O.
点评 本题考查了氧化还原反应的电子转移,结合图象的分析锌离子在不同PH范围内的存在形式,难点是(3)题化学式的确定,利用原子守恒解答.

| A. | 将Al2O3固体粉末加到沸水中 | |
| B. | 将CO2气体不断通人到NaAlO2溶液中 | |
| C. | 将过量的金属钠投入到NaAlO2溶液中 | |
| D. | 向340ml 1mol/L NaOH溶液中加入80ml 1mol/L的AlCl3溶液 |
| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
| A. |  配制溶液 | B. |  中和滴定 | ||
| C. |  除去溴苯中少量的溴单质 | D. |  制取并收集氨气 |
①FeS ②CuS ③SO2 ④SO3.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
| A. | 144.0gCuSO4 | B. | 144.0gCuSO4•5H2O | ||
| C. | 255.0gCuSO4•5H2O | D. | 250.0gCuSO4•5H2O |
 硼及其化合物在工农业生产中应用广泛.
硼及其化合物在工农业生产中应用广泛.