题目内容
7.实验室需用2mol•L-1硫酸铜溶液450mL,配制时应称取的固体质量是( )| A. | 144.0gCuSO4 | B. | 144.0gCuSO4•5H2O | ||
| C. | 255.0gCuSO4•5H2O | D. | 250.0gCuSO4•5H2O |
分析 配制450mL的硫酸铜溶液,实验室中没有450mL的容量瓶,配制时需要选用500mL容量瓶,实际上配制的是500mL 2mol/L的硫酸铜溶液,根据n=cV计算出硫酸铜的物质的量,再根据m=nM计算出溶质硫酸铜的质量,以此解答该题.
解答 解:实验室需用2mol•L-1硫酸铜溶液450mL,由于没有规格为450mL的容量瓶,配制时应该选用500mL的容量瓶,
实际上配制的溶液为500mL 2mol/L的硫酸铜溶液,
则需要硫酸铜的物质的量为:n(CuSO4)=2mol/L×0.5L=1mol,
需要无水硫酸铜的质量为:m(CuSO4)=160g/mol×1mol=160g,
需要CuSO4•5H2O的质量为:m(CuSO4•5H2O)=250g/mol×1mol=250g,
故选D.
点评 本题考查了配制一定物质的量浓度的溶液中容量瓶的选用、物质的量浓度的相关计算,侧重考查学生的分析、计算能力,题目难度不大,注意掌握配制一定物质的量浓度的溶液的方法,明确物质的量浓度的相关计算方法,正确判断容量瓶规格为解答关键.

练习册系列答案
相关题目
12.工业上制取碘酸钾的反应为:I2+2KClO3→2KIO3+Cl2,下列叙述正确的是( )
| A. | 氧化性:I2>Cl2 | B. | 每生成1 mol KIO3转移电子2 mol | ||
| C. | 该反应是置换反应 | D. | KClO3被氧化 |
19.原电池中正极发生的是( )
| A. | 氧化还原反应 | B. | 氧化反应 | C. | 还原反应 | D. | 置换反应 |
16.下列叙述不正确的是( )
| A. | 液氨常用作冷冻剂 | |
| B. | 常温下浓硫酸与浓硝酸均可用铁制容器储存 | |
| C. | 铵盐易受热分解,因此存放时氨态氮肥要密封保存,并放在阴凉通风处 | |
| D. | 活泼金属不能从稀盐酸中置换出氢气 |
17.在氢硫酸溶液中加入少量下列物质,能使溶液pH明显减小的是( )
| A. | O2 | B. | Cl2 | C. | FeSO4 | D. | SO2 |
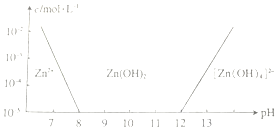 锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.
锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.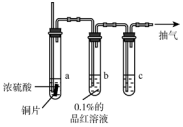 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).