题目内容
13.NA代表阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,S2和S8的固体混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 将1molFeCl3滴入足量沸水中,所分散系中粒子数目小于NA | |
| C. | 6.4g铜与硫反应时,铜失去的电子数为0.2NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合后气体中分子总数为2NA |
分析 A.根据n=$\frac{m}{M}$计算出混合物中含有S的物质的量,然后计算出含有S原子的数目;
B.沸水中粒子还包括水分子;
C.铜与硫反应生成硫化亚铜,0.1mol铜与硫完全反应失去0.1mol电子;
D.N2O4在容器中存在平衡N2O4?2NO2.
解答 解:A.S2和S8的固体混合物共6.4g,混合物中含有S的物质的量为:$\frac{6.4g}{32g/mol}$=0.2mol,所含硫原子数一定为0.2NA,故A错误;
B.沸水中的粒子除了氢氧化铁胶粒,还存在水分子,则无法判断该分散系中粒子数大小,故B错误;
C.6.4g铜的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,1molCu与硫反应生成0.5mol硫化亚铜,失去了1mol电子,失去的电子数为0.1NA,故C错误;
D.标准状况下,44.8LNO与22.4LO2混合后恰好反应生成44.8L二氧化氮,标况下44.8L二氧化氮的物质的量为2mol,由于存在平衡N2O4?2NO2,则反应后气体总物质的量小于2mol,气体中分子总数小于2NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,B为易错点,注意分散系中的粒子包括水分子和氢氧化铁胶体,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.下列无色气体中,遇空气变成红棕色的是( )
| A. | CO | B. | HCl | C. | SO2 | D. | NO |
4.同温同压下,甲乙两容器分别装有CH4和NH3气体,已知它们所含原子数相同,则甲乙两容器体积比为( )
| A. | 4:3 | B. | 4:5 | C. | 5:4 | D. | 1:1 |
1.0.5L 2mol/L FeCl3溶液与0.2L 5mol/L KCl溶液中的Cl-物质的量之比( )
| A. | 6:5 | B. | 3:2 | C. | 15:2 | D. | 3:1 |
8.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)不变,KW不变 | |
| C. | 增大水的体积,则水中 n(H+) 与n(OH-) 乘积变大 | |
| D. | 将水加热,KW增大,pH不变 |

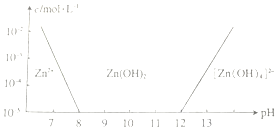 锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.
锌及其化合物有着广泛的应用.请回答有关锌及其化合物的有关问题.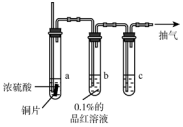 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).