题目内容
16.在分析化学中,NH3或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯.已知:NH3•H2O的电离常数K=1.8×10-5,Ksp[Mg(OH)2]=1.8×10-11.向体积为1.0L、浓度为2.0×10-4 mol•L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
分析 根据Ksp[Mg(OH)2]=1.8×10-11计算开始有白色沉淀出现时,c(OH-),再根据氨水的电离平衡常数计算c(NH3.H2O),最后计算未电离前c(NH3.H2O),据此分析计算.
解答 解:向体积为1.0L、浓度为2.0×10-4 mol•L-1的MgCl2溶液中通入NH3,开始有白色沉淀出现时,c(OH-)=$\sqrt{\frac{1.8×10{\;}^{-11}}{2.0×10{\;}^{-4}}}$mol/L=3×l0-4mol/L,
结合氨水的电离平衡常数=$\frac{c(NH{\;}_{4}{\;}^{+})•c(OH{\;}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{c{\;}^{2}(OH{\;}^{-})}{c(NH{\;}_{3}•H{\;}_{2}O)}$=1.8×l0-5,所以c(NH3.H2O)=5×l0-3mol/L,
未电离前c(NH3.H2O)=5×l0-3mol/L+3×l0-4mol/L=5.3×l0-3mol/L,
n(NH3)=5.3×l0-3mol,
通入氨气的体积=5.3×l0-3mol/L×22.4L/mol=0.11872L=118.72mL,
故选:C.
点评 本题考查了溶度积及其电离平衡常数的计算等知识点,根据其公式来分析解答,难度中等.

练习册系列答案
相关题目
6.已知:I2+2S2O32═S4O62-+2I-.相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
7.在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
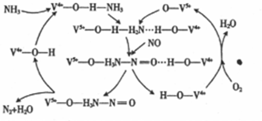
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为N2(填化学式),V4+-O-H在反应过程中作催化剂.当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为44.8L.
(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-538kJ•mol-1.断开1mol下列化学键系数的能量分别为N-H:390kJ、N≡N:946kJ、O-H:460kJ、O=O:498kJ.则断开1molN-N需要吸收的能量是190kJ.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)$?_{加热}^{催化剂}$4NO(g)+6H2O(g)△H<0.
①若其它条件不变,则下列图象不正确的是D(填字母).

②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示.
0~4min内,用O2表示该反应的平均反应速率为0.25mol•L-1•min-1.反应6~8min时改变了反应条件,改变的反应条件可能是升高温度.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为N2(填化学式),V4+-O-H在反应过程中作催化剂.当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为44.8L.

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-538kJ•mol-1.断开1mol下列化学键系数的能量分别为N-H:390kJ、N≡N:946kJ、O-H:460kJ、O=O:498kJ.则断开1molN-N需要吸收的能量是190kJ.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)$?_{加热}^{催化剂}$4NO(g)+6H2O(g)△H<0.
①若其它条件不变,则下列图象不正确的是D(填字母).

②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示.
 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
4.已知常温下:KSP[Al(OH)3]=6.0×10-18,KSP[Fe(OH)3]=4.0×10-38,某溶液中除H+,OH-外,还有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,下列有关该溶液判断不正确的是( )
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
11.下列叙述正确的是( )
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
1.在下列溶液中通入CO2气体至过量,原溶液最终出现浑浊状态的是( )
| A. | 澄清石灰水 | B. | 氢氧化钡溶液 | C. | 氯化钙溶液 | D. | 饱和碳酸钠溶液 |
8.下列对沉淀溶解平衡的描述正确的是( )
| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
6.水体污染加剧水资源短缺,严重危害人体健康.下列关于水污染的描述中不正确的是( )
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
