题目内容
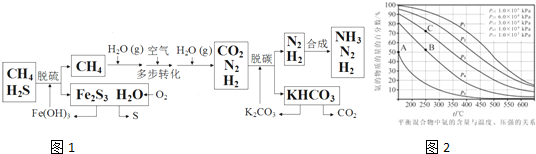
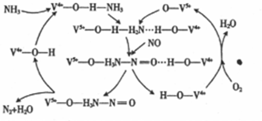
7.在当今社会,氮的氢化物和氧化物与我们的生活息息相关.(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为N2(填化学式),V4+-O-H在反应过程中作催化剂.当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为44.8L.
(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-538kJ•mol-1.断开1mol下列化学键系数的能量分别为N-H:390kJ、N≡N:946kJ、O-H:460kJ、O=O:498kJ.则断开1molN-N需要吸收的能量是190kJ.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)$?_{加热}^{催化剂}$4NO(g)+6H2O(g)△H<0.
①若其它条件不变,则下列图象不正确的是D(填字母).

②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示.
 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
分析 (1)由图该原理中的中NO最终转化为H2O和氮气;V4+-O-H在反应前后不变,作催化剂;氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量;
(2)焓变=反应物总键能-生成物总键能;
(3)①A.该反应前后气体物质的量增大,增大压强化学反应速率增大,反应到达平衡的时间缩短,平衡逆向移动,氨气转化率降低;
B.催化剂只改变化学反应速率,改变反应达到平衡的时间,但不影响平衡移动;
C.该反应前后气体物质的量增大,增大压强化学反应速率增大,反应到达平衡的时间缩短,平衡逆向移动,NO的产率降低;
D.该反应的正反应是放热反应,升高温度平衡逆向移动;
②根据v=$\frac{△c}{△t}$计算反应速率;反应6~8min时反应逆向移动,可能为升高温度.
解答 解:(1)由图1可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;V4+-O-H在反应前后不变,作催化剂;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:N2;催化剂;44.8;
(2)焓变=反应物总键能-生成物总键能,设断开1molN-N需要吸收的能量QkJ,则:Q+4×390+498-946-4×460=-538,解得Q=190;
故答案为:190kJ;
(3)①该反应是个气体体积增大、正反应放热的反应,
A、增大压强,反应逆向移动,氨气的转化率减小,且压强增大化学反应速率增大,缩短反应到达平衡的时间,所以图象符合,故A不选;
B、催化剂加快反应速率,但不改变平衡,所以图象符合,故B不选;
C、增大压强,逆向移动,NO的产率降低,所以图象符合,故C不选;
D、升高温度,反应逆向移动,水蒸气的含量降低,所以图象不符合,故D选;
故答案为:D;
②0~4min内,v(O2)=$\frac{1.75-0.75}{4}$mol/(L.min)=0.25mol/(L.min);反应6~8min时反应逆向移动,可能为升高温度,
故答案为:0.25;升高温度.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响等知识点,侧重考查学生计算及图象分析判断、知识综合运用能力,明确温度、压强、催化剂对化学反应速率、化学平衡移动影响是解本题关键,注意:催化剂只影响反应速率不影响平衡移动,题目难度不大.

| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
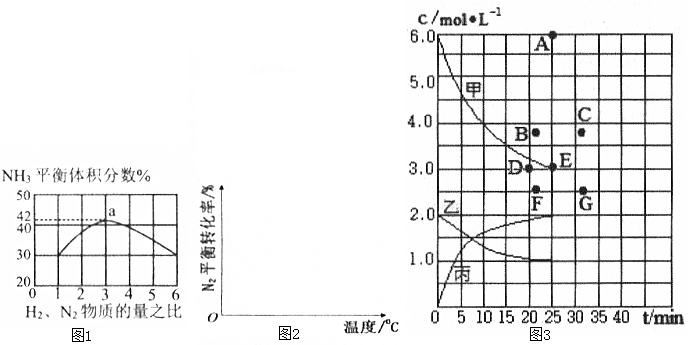
(1)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图1表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系.
①工业上合成氨的温度一般控制在500℃,原因是该温度下催化剂的活性最好.
②根据图1中a点数据计算N2的平衡体积分数为14.5%,此时H2和N2的转化率之比为1:1.
(2)合成氨工业中,在其他条件相同时,请你画出N2的平衡转化率在不同压强(p1>p2)下随温度变化的曲线图.

(3)在500℃,反应N2(g)+3H2(g)?2NH3(g)中,将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表所示.
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”).
③根据上表中数据得到的“浓度-时间”关系可用如图3中曲线表示,其中表示c(N2)-t的曲线是乙(填“甲”、“乙”或“丙”).在此温度下,若起始充入4molN2和12mol H2,反应刚达到平衡时,氢气的浓度可用B点表示(从A~G点中选择).
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(I)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.(已知:2H2(g)+O2(g)=2H2O(I)△H=-571.6kJ•mol-1)
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:(1)下表为几种共价键的键能.
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
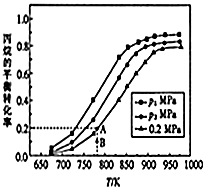
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.