题目内容
11.下列叙述正确的是( )| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
分析 A.Ag+、Cl-都抑制AgCl溶解;
B.常温下pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,
酸或碱抑制水电离;
C.若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则存在c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-);
D.常温下,醋酸电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$、醋酸根水解平衡常数Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,离子积常数Kw=c(H+).c(OH-).
解答 解:A.Ag+、Cl-都抑制AgCl溶解,常温下,物质的量浓度相同的硝酸银和氯化钠溶液其抑制AgCl溶解程度相等,所以AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度相同,故A错误;
B.常温下pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,
酸或碱抑制水电离,所以前者抑制水电离,则水的电离程度:a<b,故B错误;
C.若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则存在c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol/L,故C错误;
D.常温下,醋酸电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$、醋酸根水解平衡常数Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,离子积常数Kw=c(H+).c(OH-),则Ka.Kh=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=c(H+).c(OH-)=Kw,故D正确;
故选D.
点评 本题考查难溶物溶解平衡、离子浓度大小比较、酸碱混合溶液定性判断等知识点,侧重考查学生分析判断能力,明确溶液中存在溶质及其性质、电荷守恒是解本题关键,难点是D选项,题目难度中等.

| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
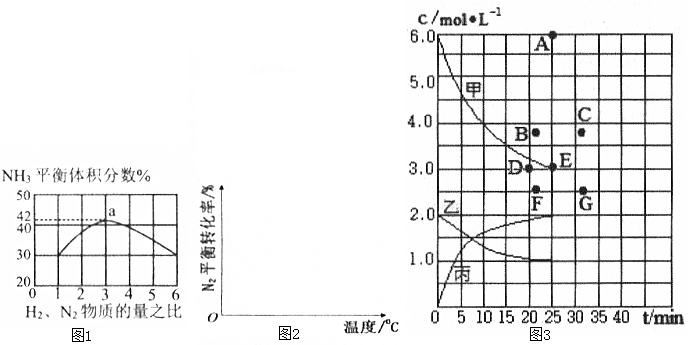
(1)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图1表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系.
①工业上合成氨的温度一般控制在500℃,原因是该温度下催化剂的活性最好.
②根据图1中a点数据计算N2的平衡体积分数为14.5%,此时H2和N2的转化率之比为1:1.
(2)合成氨工业中,在其他条件相同时,请你画出N2的平衡转化率在不同压强(p1>p2)下随温度变化的曲线图.

(3)在500℃,反应N2(g)+3H2(g)?2NH3(g)中,将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表所示.
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”).
③根据上表中数据得到的“浓度-时间”关系可用如图3中曲线表示,其中表示c(N2)-t的曲线是乙(填“甲”、“乙”或“丙”).在此温度下,若起始充入4molN2和12mol H2,反应刚达到平衡时,氢气的浓度可用B点表示(从A~G点中选择).
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(I)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.(已知:2H2(g)+O2(g)=2H2O(I)△H=-571.6kJ•mol-1)
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
| A. | 矿泉水 | B. | 蒸馏水 | C. | 自来水 | D. | 雨水 |

 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.



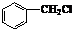
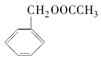 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: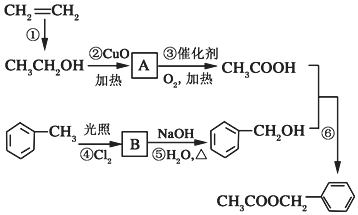
 ;
;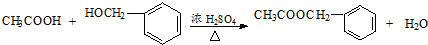 ;
;