题目内容
1.在下列溶液中通入CO2气体至过量,原溶液最终出现浑浊状态的是( )| A. | 澄清石灰水 | B. | 氢氧化钡溶液 | C. | 氯化钙溶液 | D. | 饱和碳酸钠溶液 |
分析 通入过量的CO2气体后,溶液变浑浊,说明生成物溶解度较小,难溶于或微溶于水,注意碳酸的酸性以及复分解反应的条件,以此解答该题.
解答 解:A.二氧化碳过量生成碳酸氢钙,易溶于水,故A错误;
B.二氧化碳过量时生成碳酸氢钡,易溶于水,故B错误;
C.碳酸酸性比盐酸弱,二氧化碳与氯化钙不反应,故C错误;
D.饱和碳酸钠溶液和二氧化碳反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则生成沉淀,故D正确.
故选D.
点评 本题考查了元素及其化合物的性质等,为高频考点,比较基础,注意A、B选项是与反应物量有关的反应,量不同产物不同.C选项理解复分解反应发生的条件.

练习册系列答案
相关题目
12. 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
(1)下表为几种共价键的键能.
则上述丙烷裂解反应的△H=+123KJ/mol
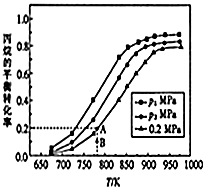
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
①二氧化碳重整丙烷制取丙烯的反应属于吸热(填“放热”或“吸热”)反应.
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:(1)下表为几种共价键的键能.
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.
9.下列有关说法正确的是( )
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
16.在分析化学中,NH3或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯.已知:NH3•H2O的电离常数K=1.8×10-5,Ksp[Mg(OH)2]=1.8×10-11.向体积为1.0L、浓度为2.0×10-4 mol•L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
13.根据下列反应的化学方程式,判断有关物质的还原性强弱( )
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
10.设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气与11.2LNH3含有的原子数相同 | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
11.将标准状况下体积为2.24L的H2S缓慢通入100rnl 1.5mol/LNaOH溶液中(溶液体积变化忽略不计)充分反应后,下列关系式中错误的是( )
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
 常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: