题目内容
4.已知常温下:KSP[Al(OH)3]=6.0×10-18,KSP[Fe(OH)3]=4.0×10-38,某溶液中除H+,OH-外,还有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,下列有关该溶液判断不正确的是( )| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
分析 溶液中除H+、OH-外,还含有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,由Al3+,Fe3+,Cl-所带的电荷3×1+3×1<1×7可知,溶液为酸性溶液,是氯化铝、氯化铁、氯化氢的混合溶液.
A、溶液呈酸性,滴加Na2CO3溶液先与酸反应;
B、根据电荷守恒计算氯化氢产生的氢离子浓度,在根据PH=-logc(H+)计算;
C、往溶液中加入NaOH溶液,溶解度小的先沉淀;
D、根据电荷守恒.
解答 解:溶液中除H+、OH-外,还含有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,由Al3+,Fe3+,Cl-所带的电荷3×1+3×1<1×7可知,溶液为酸性溶液,是氯化铝、氯化铁、氯化氢的混合溶液.
A、向溶液中滴加Na2CO3溶液,先与酸反应,不会立即产生沉淀和气体,故A错误;
B、若溶液中c(Cl-)=0.07 mol/L,则c(Al3+)=0.01mol/L,c(Fe3+)=0.01mol/L,则c(H+)×1+c(Al3+)×3+c(Fe3+)×3=c(Cl-)×1,即c(H+)×1+0.01mol/L×3+0.01mol/L×3=0.07mol/L×1,解得c(H+)=0.01mol/L,所以溶液PH=-logc(H+)=2,故B正确;
C、KSP[Fe(OH)3]<KSP[Al(OH)3]=6.0×10-18,组成相似,所以S[Fe(OH)3]<S[Al(OH)3],加氢氧化钠,溶解度小的先沉淀,故先出现红褐色沉淀,故C正确;
D、往溶液中通入NH3,铁离子、铝离子均被沉淀,由电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(Cl-),直至溶液呈中性,则c(H+)=c(OH-),得到C(NH4+)═C(Cl-),故D正确;
故选:A.
点评 本题考查溶液中离子共存问题、溶液计算等,综合性强,难度中等,判断溶液是氯化铝、氯化铁、氯化氢的混合溶液是解题关键.

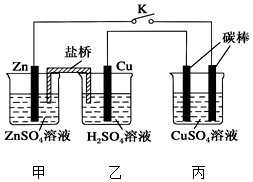 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:(1)下表为几种共价键的键能.
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
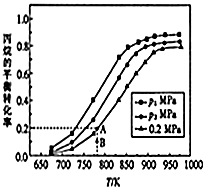
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
A.HCl H2SO4 H2CO3 HNO3
B.溶液 水 悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |