题目内容
8.下列对沉淀溶解平衡的描述正确的是( )| A. | BaSO4属于难溶物,它在水中完全不能溶解 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
分析 A.绝对难溶的物质不存在;
B.沉淀溶解达到平衡是动态平衡;
C.溶质组成不同,离子浓度不一定相同;
D.沉淀溶解达到平衡时,在加入该沉淀沉淀不能继续溶解,固体的浓度为常数,加入难溶的该沉淀物,平衡不发生移动.
解答 解:A.BaSO4属于难溶物,它在水中溶解度小,溶解的全部电离,故A错误;
B.沉淀的速率和溶解的速率相等,沉淀溶解达到平衡,沉淀的速率和溶解的速率相等,故B正确;
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,与难溶二者是否是1:1型有关、与溶解难溶物质的溶液中是否存在难溶物质的离子等有关,故C错误;
D、沉淀溶解达到平衡时,如果再加入难溶的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,故D错误;
故选B.
点评 本题考查难溶物质的溶解平衡,题目难度不大,注意利用平衡移动原理、溶度积常数理解.

练习册系列答案
相关题目
16.在分析化学中,NH3或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯.已知:NH3•H2O的电离常数K=1.8×10-5,Ksp[Mg(OH)2]=1.8×10-11.向体积为1.0L、浓度为2.0×10-4 mol•L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
13.根据下列反应的化学方程式,判断有关物质的还原性强弱( )
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
18.下列说法错误的是( )
| A. | 分子的稳定性与分子间作用力的大小无关 | |
| B. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| C. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |





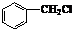
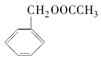 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: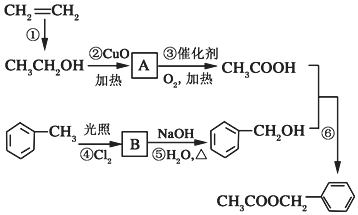
 ;
;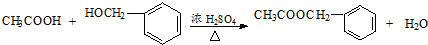 ;
;