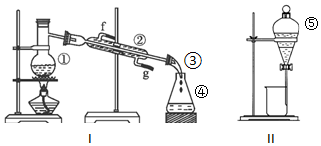
题目内容
5.为了除去KNO3溶液中少量的Mg(NO3)2、MgSO4,可选用Ba(OH)2、HCl、HNO3、Na2CO3和K2CO3试剂,按如下步骤操作:
(1)上述试剂中,B是K2CO3,C是HNO3.
(2)操作I的名称是过滤.
(3)加过量A时发生有关反应的离子反应方程式为Mg2++2OH-=Mg(OH)2↓、Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓.
(4)加过量B的目的是除去过量的A.
分析 为了除去KNO3溶液中少量的Mg(NO3)2、MgSO4,要除去杂质得到较纯净的KNO3,应该加入除杂剂除去镁离子、硫酸根离子,用氢氧化钡除去硫酸根离子、镁离子,然后用碳酸钾除去钡离子,最后用硝酸除去过量的碳酸钾,
所以溶液中先加入过量氢氧化钡溶液,则A是Ba(OH)2,然后加入B,B除去过量的氢氧化钡,B为K2CO3,操作I是过滤,得到的滤液中含有硝酸钾、碳酸钾,然后加入过量C,C除去过量的碳酸钾,C为HNO3,然后通过蒸发浓缩、冷却结晶、过滤得到硝酸钾晶体,结合题目分析解答.
解答 解:为了除去KNO3溶液中少量的Mg(NO3)2、MgSO4,要除去杂质得到较纯净的KNO3,应该加入除杂剂除去镁离子、硫酸根离子,用氢氧化钡除去硫酸根离子、镁离子,然后用碳酸钾除去钡离子,最后用硝酸除去过量的碳酸钾,
所以溶液中先加入过量氢氧化钡溶液,则A是Ba(OH)2,然后加入B,B除去过量的氢氧化钡,B为K2CO3,操作I是过滤,得到的滤液中含有硝酸钾、碳酸钾,然后加入过量C,C除去过量的碳酸钾,C为HNO3,然后通过蒸发浓缩、冷却结晶、过滤得到硝酸钾晶体,
(1)通过以上分析知,B、C分别为K2CO3、HNO3,故答案为:K2CO3;HNO3;
(2)分离难溶性固体和溶液采用过滤方法,则操作I为过滤,故答案为:过滤;
(3)加入过量A时,镁离子和氢氧根离子反应生成氢氧化镁沉淀、硫酸镁和氢氧化钡反应生成硫酸钡沉淀和氢氧化镁沉淀,离子方程式分别为Mg2++2OH-=Mg(OH)2↓、Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓;
(4)加入过量B的目的是除去过量的A,故答案为:除去过量的A.
点评 本题考查物质分离提纯综合运用,为高频考点,侧重考查学生分析判断及实验设计能力,明确元素化合物性质、物质分离提纯方法是解本题关键,注意除杂时不能引进新的杂质,题目难度不大.

| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
①2Fe2++Cl2═2Fe3++2Cl-
②I2+SO2+2H2O═H2SO4+2HI
③2Fe3++2I-═2Fe2++I2.
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
| A. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气与11.2LNH3含有的原子数相同 | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
A.HCl H2SO4 H2CO3 HNO3
B.溶液 水 悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?CO Cl2(g)△H=-108kJ/mol,反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.2 | 0.6 |
| 1 | 0.9 | |
| 2 | 0.2 | |
| 4 | 0.8 |
②在2~4min间v(Cl2)正=v(Cl2)逆(填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2(g)?CO Cl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数
B.使用合适的催化剂可以增大反应体系中COCl2(g)的体积分数
C.若改变某个反应条件,反应体系中COCl2(g)的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K 值不变时,说明反应已经达到平衡
(3)用CO与H2在高温下合成C5H12(汽油的一种成分).己知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(l)表示L一定时,CO的转化率随X的变化关系,则X代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.

(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1molCH4,理论上需要消耗CO的物质的量为4mol.
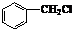
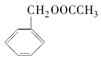 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: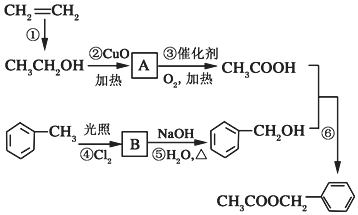
 ;
;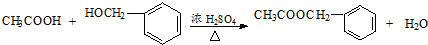 ;
;