题目内容
8.钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8.其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.Y3+与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是( )| A. | W的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性<W的氢化物稳定性 | |
| C. | Y的氧化物既能与盐酸,又能与NaOH溶液反应 | |
| D. | X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
分析 只有W显负价,应为O元素,Y3+与W的阴离子具有相同的电子层结构,Y为Al元素,X、Y的最外层电子数之和与Z的最高正价数相等,可知该硅酸盐中,Z应为Si元素,X的化合价为+1价,X、W的质子数之和等于Y、Z的质子数之和,则X为K元素,以此解答该题.
解答 解:只有W显负价,应为O元素,Y3+与W的阴离子具有相同的电子层结构,Y为Al元素,X、Y的最外层电子数之和与Z的最高正价数相等,可知该硅酸盐中,Z应为Si元素,X的化合价为+1价,X、W的质子数之和等于Y、Z的质子数之和,则X为K元素,该硅酸盐为KAlSi3O8,
A.O2-与Al3+具有相同的核外电子排布,核电荷数越小离子半径越大,故A正确;
B.非金属性O>Si,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.Al2O3为两性氧化物,既能与盐酸反应,又能与NaOH溶液反应,故C正确;
D.K2O2、Al2O3两种化合物都为离子化合物,K2O2含有离子键和共价键,而Al2O3只含有离子键,故D错误.
故选D.
点评 本题考查学生利用原子结构的关系来推断元素,利用物质的结构和性质来分析解答问题,推断元素是解答本题的难点,题中最外层电子数以及原子序数的关系解答该题的关键,答题时要注意,应学会利用假设和验证的方法来解答.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
9.能正确表示下列反应的离子方程式是( )
| A. | 金属铝溶于稀硫酸中:Al+2H+═A13++H2↑ | |
| B. | 少量Cl2通入KI溶液中:Cl2+2I-═2C1-+I2 | |
| C. | 醋酸钠水溶液中通入足量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| D. | 碳酸锌溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ |
19.现在含有元素硒(Se)的保健品已经开始进入市场,已知它与氧元素同族,与钾元素同周期,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Se的非金属性比Br强 | |
| D. | 气态氢化物的稳定性比硫化氢气体弱 |
16.将洁净的金属片 Fe、Zn、A、B 分别与 Cu 用导线连结浸在合适的电解质溶 液里.实验并记录电压指针的移动方向和电压表的读数如下表所示:
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越大(填“大”、“小”).Zn、A、B 三种金属活动性由强到弱的顺序是Zn>B>A.
(2)Cu 与 A 组成的原电池Cu为负极,此电极反应式为Cu-2e-=Cu2+.
(3)A 与 B 组成的原电池,电子流向为B→A.(填 A→B 或 B→A)
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
(1)构成两电极的金属活动性相差越大,电压表的读数越大(填“大”、“小”).Zn、A、B 三种金属活动性由强到弱的顺序是Zn>B>A.
(2)Cu 与 A 组成的原电池Cu为负极,此电极反应式为Cu-2e-=Cu2+.
(3)A 与 B 组成的原电池,电子流向为B→A.(填 A→B 或 B→A)
13.向10mL 0.1mol•L-1 (NH4)Al(SO4)2溶液中滴加等浓度Ba(OH)2溶液x mL.下列表述正确的是( )
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) | |
| B. | x=20时溶液导电能力比x=15时溶液导电能力强 | |
| C. | x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) | |
| D. | x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
20.某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:2SO2(g)+O2(g)?2SO3(g)+Q下列说法正确的是( )
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 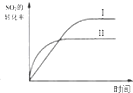 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 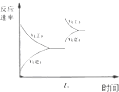 图中t0时增大压强,使平衡向正反应方向进行 |
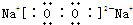 ,其中含有的化学键类型为离子键、非极性键
,其中含有的化学键类型为离子键、非极性键