题目内容
8.银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液.工作时原电池的总反应是:Ag2O+Zn+H2O═2Ag+Zn(OH)2,根据上述变化判断:①原电池的正极是Ag2O.
②工作时原电池两极反应式为:负极Zn-2e+2OH-═Zn(OH)2,正极Ag2O+H2O+2e═2Ag+2OH-
③工作时原电池负极附近的pH值减小(填“增大”、“不变”、“减小”)
分析 根据化合价变化可知Zn被氧化,应为原电池的负极,电极反应为Zn+2OH-=Zn(OH)2+2e-,则正极为Ag2O,被还原,电极反应为Ag2O+H2O+2e-=2Ag+2OH-,结合电极方程式解答该题.
解答 解:①根据工作时原电池的总反应:Ag2O+Zn+H2O═2Ag+Zn(OH)2,正极上是发生得电子的还原反应,所以正极材料是:Ag2O,故答案为:Ag2O;
②原电池的负极上是发生失电子的氧化反应,正极上是发生得电子的还原反应,两极反应式为:负:Zn-2e+2OH-═Zn(OH)2;正:Ag2O+H2O+2e═2Ag+2OH-,
故答案为:Zn-2e+2OH-═Zn(OH)2;Ag2O+H2O+2e═2Ag+2OH-;
③工作时原电池负极反应为:Zn-2e+2OH-═Zn(OH)2,该电极附近消耗氢氧根离子,所以溶液的pH值减小,故答案为:减小.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.

练习册系列答案
相关题目
3.火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2=Cu2S+2FeS+SO2则下列说法正确的是( )
| A. | CuFeS 2 仅作还原剂,硫元素被氧化 | |
| B. | 每生成1mol Cu2 S,有4 mol硫被氧化 | |
| C. | SO 2 只是氧化产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.2mol硫被氧化 |

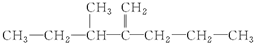 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯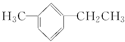 ,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.
,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.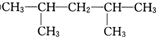
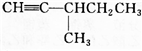 .
.
 (或写成
(或写成 R代表取代基或氢)
R代表取代基或氢)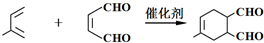 .
.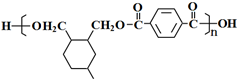 .
.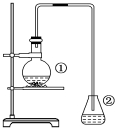 为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. ②中离子方程式为Br-+Ag+═AgBr↓.
②中离子方程式为Br-+Ag+═AgBr↓.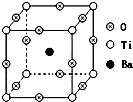 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.