题目内容
20.下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO3->I-,氧化性IO3->I2>SO${\;}_{4}^{2-}$.向含有xmolNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x=3mol.
分析 还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2,由图分析解答.
解答 解:还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,加入1mol的KIO3溶液,xmolNaHSO3恰好完全反应,所以$\frac{2}{1}=\frac{6}{x}$,解之得x=3mol,故答案为:3.
点评 本题是一道有关氧化还原反应的综合题,考查角度广,难度中等,要求学生具有分析和解决问题的能力.

练习册系列答案
相关题目
10.下列溶液中,可以大量共存的离子组是( )
| A. | H+、Na+、SO42-、HCO3- | B. | NH4+、Fe3+、SO42-、OH- | ||
| C. | Na+、K+、AlO2-、Cl- | D. | Fe2+、Ba+、SO42-、NO3- |
11.设 NA 为阿伏加德罗常数,下列说法不正确的是( )
| A. | 常温常压下,0.05 NA 个 CO2 分子所占体积为 1.12 L | |
| B. | 标准状况时,22.4 L CH4 和CO2 的混合气体所含分子数为 NA | |
| C. | 500 mL 0.2 mol•L-1CaCl2 溶液中 Cl- 离子总数为 0.2 NA | |
| D. | NA 个 H2O 分子的质量与 H2O 的摩尔质量在数值上相等 |
8.下列关于甲烷的说法中,不正确的是( )
| A. | 是天然气的主要成分 | B. | 甲烷是正四面体型分子 | ||
| C. | 分子中C的质量分数为75% | D. | 甲烷不能发生氧化反应 |
15.关于钠的叙述中,不正确的是( )
| A. | 金属钠与水反应庄成氢气,但是实验室中不能用金属钠与水反应制备氢气 | |
| B. | 金属钠放在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,发出黄色火焰 | |
| C. | 金属钠在空气中放置会生成氧化钠,在空气中燃烧则会生成过氧化钠 | |
| D. | 金属钠与氧气反应的产物取决于氧气的用量 |
1.下列反应中,熵值显著增加的反应是( )
| A. | CO(g)+2H2(g)═CH3OH(l) | |
| B. | 2Cu(s)+O2(g)═2CuO(s) | |
| C. | NH3(g)+HCl(g)═NH4Cl(s) | |
| D. | CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l) |
5.(CH3)2CHC(C2H5)2C(CH3)2C2H5 的正确命名是( )
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-异丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |
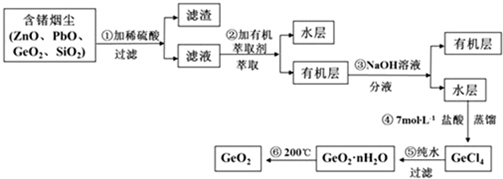
 (3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).
(3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).