题目内容
20.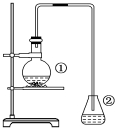 为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲用如图装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.(1)装置中①的化学方程式为2Fe+3Br2═2FeBr3,
 ②中离子方程式为Br-+Ag+═AgBr↓.
②中离子方程式为Br-+Ag+═AgBr↓.(2)①中长导管的作用是导气,冷凝回流.
(3)烧瓶中生成的红褐色油状物,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
(4)由于装置没有除去混在HBr中的Br2而使通过滴有AgNO3的锥形瓶中有浅黄色的沉淀生成来证明苯与溴发生了取代反应的结论可信程度降低,可在①与②间接入一个装CCl4或苯的洗气瓶.
分析 (1)溴与铁反应生成溴化铁,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢;溴离子与银离子生成了溴化银沉淀;
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液;
(4)反应中HBr中混有溴,可用盛有苯或四氯化碳的洗气瓶除杂.
解答 解:(1)因溴与铁反应生成溴化铁:2Fe+3Br2 ═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢: ;②中反应的离子方程式为Br-+Ag+═AgBr↓,
;②中反应的离子方程式为Br-+Ag+═AgBr↓,
故答案为:2Fe+3Br2═2FeBr3; ;Br-+Ag+═AgBr↓;
;Br-+Ag+═AgBr↓;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,故答案为:导气,冷凝回流;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,
故答案为:NaOH溶液(或水);分液漏斗;
(4)放热放热,导致溴挥发,反应中HBr中混有溴,可用盛有苯或四氯化碳的洗气瓶除杂,
故答案为:Br2;CCl4或苯.
点评 本题考查制备实验,为高频考点,把握溴苯的制备、混合物分离提纯、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
14.在化学实验室进行下列实验操作时,其操作或记录的数据正确的是( )
| A. | 用托盘天平称取8.84 g食盐 | |
| B. | 用220 mL容量瓶配制所需的220 mL 0.1 mol/L NaOH溶液 | |
| C. | 用量筒量取12.12 mL盐酸 | |
| D. | 用0.1200 mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40 mL |
15.关于钠的叙述中,不正确的是( )
| A. | 金属钠与水反应庄成氢气,但是实验室中不能用金属钠与水反应制备氢气 | |
| B. | 金属钠放在石棉网上加热时,先熔化成银白色小球,然后剧烈燃烧,发出黄色火焰 | |
| C. | 金属钠在空气中放置会生成氧化钠,在空气中燃烧则会生成过氧化钠 | |
| D. | 金属钠与氧气反应的产物取决于氧气的用量 |
15.某化学小组设计了如图1所示的数字化实验装置,研究常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图2所示,则下列说法中正确的是( )


| A. | pH=4.0时,图中n(HA-)约为0.0091mol | |
| B. | 该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂 | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
5.(CH3)2CHC(C2H5)2C(CH3)2C2H5 的正确命名是( )
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-异丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |
12.下列试剂中,能用于检验酒精中是否含有水的是( )
| A. | 硫酸铜晶体 | B. | 浓硫酸 | C. | 无水硫酸铜 | D. | 钠 |
9.设NA从为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 18g重水含有10NA 个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3 NA | |
| C. | 常温下0.05 mol•L-1Fe2(S04 ) 3溶液中含Fe 3+数目小于0.1NA | |
| D. | 用惰性电极电解饱和食盐水,当阴极得到2NA个电子时阳极产生22.4 L气体 |
10.(1)元素周期表分为7个横行,即7个周期,周期表中有18个纵行,共16个族.
(2)写出下列物质的电子式:①CO2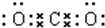 ;②NaOH
;②NaOH .
.
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
①在这些元素中最活泼的非金属元素是F.
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.
(2)写出下列物质的电子式:①CO2
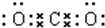 ;②NaOH
;②NaOH .
.(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.