题目内容
13.以烯烃为原料,合成某些高聚物的路线如下: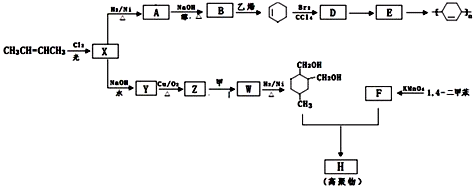
已知:
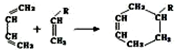 (或写成
(或写成 R代表取代基或氢)
R代表取代基或氢)(1)CH3CH=CHCH3的名称是2-丁烯.
(2)X中含有的官能团是碳碳双键、氯原子.
(3)D→E的反应类型是消去反应.
(4)甲为烃,F能与NaHCO3反应产生CO2.
①下列有关说法正确的是ad.
a.有机物Z能发生银镜反应 b.有机物Y与HOCH2CH2OH 互为同系物
c.有机物Y的沸点比B低 d.有机物F能与己二胺缩聚成聚合物
②Y的同分异构体有多种,写出分子结构中含有酯基的所有同分异构体的结构简式HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3.
③Z→W的化学方程式是
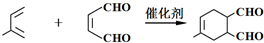 .
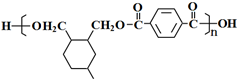
.(5)高聚物H的结构简式是
 .
.
分析 2-丁烯和氯气发生取代反应生成X,X和氢气发生加成反应生成A,A和氢氧化钠的醇溶液发生消去反应生成B,B和乙醇反应生成环己烯,结合题给信息知,B是1,3-丁二烯,A是1,4-二氯丁烷,X是1,4-二氯2-丁烯,环己烯和溴发生加成反应生成D1,2-二溴环己烷,1,2-二溴环己烷发生消去反应生成E,E发生加聚反应生成 ;
;
1,4-二氯2-丁烯和氢氧化钠的水溶液发生取代反应生成Y 1,4-二羟基2-丁烯,1,4-二羟基2-丁烯被氧气氧化生成Z,Z的结构简式为:HOCCH=CHCHO,Z和甲反应生成W,W和氢气发生加成反应生成 ,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为:
,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为: ,甲和Z发生加成反应生成W,W的结构简式为:
,甲和Z发生加成反应生成W,W的结构简式为: ,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和
,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和 发生酯化反应生成H,则H的结构简式为:
发生酯化反应生成H,则H的结构简式为: ,以此解答该题.
,以此解答该题.
解答 解:2-丁烯和氯气发生取代反应生成X,X和氢气发生加成反应生成A,A和氢氧化钠的醇溶液发生消去反应生成B,B和乙醇反应生成环己烯,结合题给信息知,B是1,3-丁二烯,A是1,4-二氯丁烷,X是1,4-二氯2-丁烯,环己烯和溴发生加成反应生成D1,2-二溴环己烷,1,2-二溴环己烷发生消去反应生成E,E发生加聚反应生成 ;
;
1,4-二氯2-丁烯和氢氧化钠的水溶液发生取代反应生成Y 1,4-二羟基2-丁烯,1,4-二羟基2-丁烯被氧气氧化生成Z,Z的结构简式为:HOCCH=CHCHO,Z和甲反应生成W,W和氢气发生加成反应生成 ,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为:
,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为: ,甲和Z发生加成反应生成W,W的结构简式为:
,甲和Z发生加成反应生成W,W的结构简式为: ,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和
,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和 发生酯化反应生成H,则H的结构简式为:
发生酯化反应生成H,则H的结构简式为: .
.
(1)CH3CH=CHCH3的名称是2-丁烯,故答案为:2-丁烯;
(2)X是1,4-二氯2-丁烯,所以X含有的官能团是碳碳双键和氯原子,故答案为:碳碳双键、氯原子;
(3)1,2-二溴环己烷发生消去反应生成E,故答案为:消去反应;
(4)①a.有机物Z的结构简式为:HOCCH=CHCHO,所以能发生银镜反应,故正确;
b.有机物Y是1,4-二羟基2-丁烯,Y中含有碳碳双键,HOCH2CH2OH中不含碳碳双键,所以二者不是 同系物,故错误;
c.有机物Y是1,4-二羟基2-丁烯,B是B是1,3-丁二烯,Y的相对分子质量比B大,所以Y的沸点比B高,故错误;
d.有机物F是1,4-二苯甲酸,所以能与己二胺缩聚成聚合物,故正确;
故选ad;
②Y是1,4-二羟基2-丁烯,Y的同分异构体有多种,分子结构中含有酯基的所有同分异构体的结构简式为:
HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3,
故答案为:HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3;
③在催化剂条件下,Z发生加成反应生成W,反应方程式为: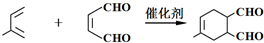 ,
,
故答案为: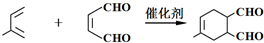 ;
;
(5)通过以上分析知,H的结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物的推断,为高考常见题型,明确有机物的官能团及其性质是解本题关键,采用正逆相结合的方法进行推断,知道常见的反应类型及断键方式,难度中等.

| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 2:1 |
| A. | 是天然气的主要成分 | B. | 甲烷是正四面体型分子 | ||
| C. | 分子中C的质量分数为75% | D. | 甲烷不能发生氧化反应 |
| A. | CO(g)+2H2(g)═CH3OH(l) | |
| B. | 2Cu(s)+O2(g)═2CuO(s) | |
| C. | NH3(g)+HCl(g)═NH4Cl(s) | |
| D. | CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l) |
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| B. | 硬脂酸甘油酯和油酸甘油酯互为同系物 | |
| C. | 三硝基甲苯的分子式为C7H5N3O6 | |
| D. | 淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体 |
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-异丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |

| A. | ①③④ | B. | ④⑦ | C. | ④⑥⑦ | D. | ①⑦⑧ |