题目内容
15.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成,进行如下实验:9.4gX$→_{步骤Ⅰ}^{过量NaOH溶液}$6.4固体$→_{步骤Ⅱ}^{过量盐酸}$蓝色溶液1.92g固体
下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
分析 9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2O3,1.92g固体为铜,以此解答该题.
解答 解:A.步骤Ⅰ中,加入过量氢氧化钠溶液固体质量减少了3 g,溶解的物质可能是Al2O3和SiO2中的一种或两种,故A错误;
B.步骤Ⅱ中加入过量盐酸,Fe2O3溶解后又和Cu发生反应,故减少的固体是Fe2O3和Cu,故B错误;
C.根据步骤I只能判断混合物中至少含有Al2O3、SiO2的一种物质,无法确定Al2O3、SiO2是否都存在;步骤II可以确定一定存在Fe2O3、Cu,故C错误;
设氧化铁的物质的量是x,金属铜的物质的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,则160x+64y=6.4,64y-64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化铁的质量为0.02mol×160g/mol=3.2g,金属铜的质量为0.05mol×64g/mol=3.2g,则原混合物中m(Fe2O3):m(Cu)=1:1,故D正确.
故选D.
点评 本题考查物质的检验和含量的测定,有关化学反应的简单计算,题目难度中等,注意掌握检验未知物的采用方法,能够根据反应现象判断存在的物质,选项D为难点和易错点,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的质量.

练习册系列答案
相关题目
6.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
20.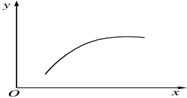 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
7.X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,X与W、Y与R分别同主族.Z在短周期元素中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍.下列叙述错误的是
( )
( )
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
4.下列说法正确的是( )
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. |  的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的质子数为94,中子数为238,电子数为144 |
5.化学与人类关系密切.下列说法不正确的是( )
| A. | SO2可用于加工食品,使食品增白 | |
| B. | NaOH可用于清洗抽油烟机 | |
| C. | 葡萄糖可用于合成保健药物维生素C | |
| D. | 聚丙烯塑料可用作食品保鲜膜 |
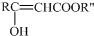
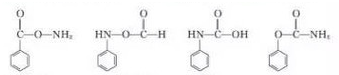
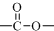 结构;
结构;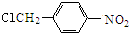 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$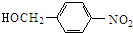 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$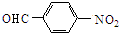
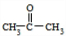 ;E
;E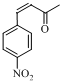
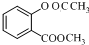 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$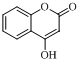 +CH3OH.
+CH3OH.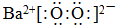 .
.