题目内容
14.下列属于氧化物的是( )| A. | NaCl | B. | MgO | C. | H2SO4 | D. | NaOH |
分析 根据氧化物的概念:氧化物是只含有两种元素且其中一种元素是氧元素的化合物,据此进行分析解答.
解答 解:A、氯化钠是由Na、Cl2种元素组成的化合物,不属于氧化物,故A错误;
B、MgO是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,故B正确;
C、硫酸是由三种元素组成的化合物,不属于氧化物,故C错误;
D、氢氧化钠是三种元素组成的化合物,不属于氧化物,故D错误.
故选:B.
点评 本题难度不大,抓住氧化物的特征、熟悉常见的物质的组成是正确解答本题的关键.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
2.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(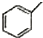 )的一氯代物 )的一氯代物 | D. | 立体烷( 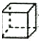 )的二氯代物 )的二氯代物 |
19.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
6.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
4.下列说法正确的是( )
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. |  的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的质子数为94,中子数为238,电子数为144 |
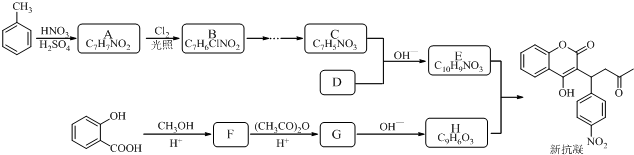
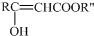
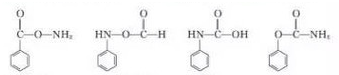
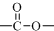 结构;
结构;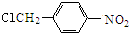 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$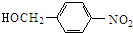 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$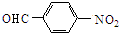
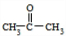 ;E
;E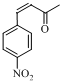
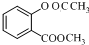 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$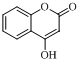 +CH3OH.
+CH3OH.