题目内容
10.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 62g白磷中含有2NA个白磷分子 | |
| B. | 1L 0.2mol/L Ba(NO3)2溶液中含有0.2NA个NO3- | |
| C. | 标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4mol HCl被氧化时,生成2NA Cl2 | |
| D. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,0H-数10-7NA |
分析 A、白磷分子为P4;
B、求出硝酸钡的物质的量,然后根据1mol硝酸钡中含2mol硝酸根来分析;
C、盐酸和二氧化锰的反应中,被氧化的盐酸生成氯气;
D、溶液体积不明确.
解答 解:A、白磷分子为P4,故62g白磷中白磷分子的物质的量为n=$\frac{62g}{124g/mol}$=0.5mol,故含0.5NA个白磷分子,故A错误;
B、溶液中硝酸钡的物质的量n=CV=0.2mol/L×1L=0.2mol,而1mol硝酸钡中含2mol硝酸根,故0.2mol硝酸钡中含0.4NA个硝酸根,故B错误;
C、盐酸和二氧化锰的反应中,被氧化的盐酸生成氯气,故当4molHCl被氧化时,生成2mol氯气即2NA个氯气分子,故C正确;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
20.化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是( )
| A. | 空气中PM2.5(2.5微米以下的颗粒物)的存在一定能够形成丁达尔效应 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物材料 | |
| D. | 水体的富营养化与含N、P洗衣粉广泛使用有关 |
1.下列有关实验操作、现象和解释或结论都正确的是( )
| 编号 | 实验操作 | 现象 | 解释或结论 |
| A | 在稀硝酸中加入过量的铁粉,充分反应后滴人KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| B | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生了取代反应生成了溴苯 |
| C | Cl2通人品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| A. | A | B. | B | C. | C | D. | D |
2.根据下列实验和现象,所得实验结论正确的是( )
| 实验 | 现象 | 实验结论 | |
| A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-,SO32-,HSO3-中的一种或几种 |
| B | 将纯碱和硫酸反应生成的气体,通入一定浓度Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 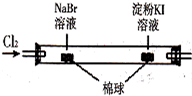 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| D | 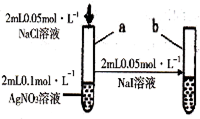 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
6.①以下表格中实验记录正确的是C
②将SO2通入BaCl2溶液中以后,再加入以下AB物质可以改变实验现象
A.NH3 B.Cl2 C.H2 D.HCl
②将SO2通入BaCl2溶液中以后,再加入以下AB物质可以改变实验现象
A.NH3 B.Cl2 C.H2 D.HCl
| 实验 | 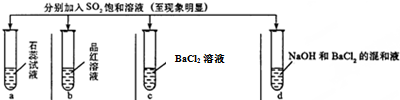 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
7.根据元素在周期表中的位置可以预测( )
| A. | 分解温度:CH4>H2S | B. | 氧化性:NaClO>Na2SO3 | ||
| C. | 同浓度溶液pH:Na2SiO3>Na2CO3 | D. | 金属性:Ca>Na |
 ),写出有关方程式,并注明反应类型.
),写出有关方程式,并注明反应类型.