题目内容
1.下列有关实验操作、现象和解释或结论都正确的是( )| 编号 | 实验操作 | 现象 | 解释或结论 |
| A | 在稀硝酸中加入过量的铁粉,充分反应后滴人KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| B | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生了取代反应生成了溴苯 |
| C | Cl2通人品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入过量的铁粉,反应生成硝酸亚铁;
B.苯和液溴在溴化铁作催化剂条件下能反应生成溴苯,苯能萃取溴水中的溴;
C.HClO具有漂白性;
D.氧化剂的氧化性大于氧化产物的氧化性.
解答 解:A.加入过量的铁粉,反应生成硝酸亚铁,充分反应后滴入KSCN溶液,溶液不变红色,故A错误;
B.苯和液溴在溴化铁作催化剂条件下能反应生成溴苯,苯能萃取溴水中的溴而使溴水褪色,苯密度小于溴,所以油状液体应该在试管上部,故B错误;
C.Cl2通入品红溶液中,溶液褪色可知HClO具有漂白性,而氯气不具有漂白性,故C错误;
D.氧化剂的氧化性大于氧化产物的氧化性,淀粉试液变蓝色,说明碘酸钾和HI发生氧化还原反应生成碘,碘酸钾中I元素化合价由+5价变为0价、HI中I元素化合价由-1价变为0价,所以碘酸钾是氧化剂、碘是氧化产物,则氧化性KIO3>I2,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、取代反应、漂白性、氧化性比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
11.下列气体在常温常压下不能共存的是( )
| A. | NH3、HCl | B. | CH4、Cl2 | C. | H2S、O2 | D. | SO2、O2 |
12.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、E单质常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,D是地壳中含量最多的金属元素.有关上述元素的下列说法,正确的是( )
| A. | B的单质在自然界只有一种核素 | |
| B. | E的单质与任何物质反应,都只表现氧化性 | |
| C. | 元素C、D、E的原子中,原子半径依次减小 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
9.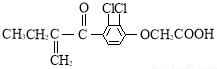 兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
 兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )| A. | 该有机物能发生酯化反应 | |
| B. | 该有机物属于芳香烃 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1 mol 该物质最多跟5mol氢气发生反应 |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 1 L浓度为1 mol•L-1的 H2O2水溶液中含有的氧原子数为2NA | |
| D. | MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA |
6.下列物质的熔点,前者大于后者的是( )
| A. | 晶体硅、碳化硅 | B. | 氯化钠、甲苯 | C. | 氧化钠、氧化镁 | D. | 钾钠合金、钠 |
13.下列实验操作能达到目的是( )
| A. | 加热氯化铵固体制取氨气 | |
| B. | 检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色 | |
| C. | 除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 滴有酚酞的碳酸钠中,加入氯化钡溶液后,红色变浅,证明碳酸钠溶液中存在水解平衡 |
10.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 62g白磷中含有2NA个白磷分子 | |
| B. | 1L 0.2mol/L Ba(NO3)2溶液中含有0.2NA个NO3- | |
| C. | 标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4mol HCl被氧化时,生成2NA Cl2 | |
| D. | 25℃时,pH=7的NH4Cl和NH3•H2O的混合溶液中,0H-数10-7NA |
18.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 丙炔 | D. | 丙烯 |