题目内容
12. 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |
分析 A、随反应的进行,C的浓度增大,当C的浓度达最大值时达平衡状态,随后温度的改变平衡发生移动;
B、温度越高反应速率越快;
C、A与B的转化率相等,所以起始量之比等于计量数之比;
D、最高点是平衡移动,曲线上的点都是平衡状态;
解答 解:A、随反应的进行,C的浓度增大,当C的浓度达最大值时达平衡状态,随后温度的改变平衡发生移动,所以升高温度平衡逆向移动,所以正反应是放热反应,故A错误;
B、温度越高反应速率越快,b点温度高反应速率快,故B错误;
C、A与B的转化率相等,所以起始量之比等于计量数之比,所以x=2,故C错误;
D、最高点是平衡移动,曲线上的点都是平衡状态,所以b状态时:v(正)=v(逆),故D正确;
故选D.
点评 本题考查化学平衡计算、化学平衡的移动、图象的分析,比较基础,旨在考查学生对基础知识的巩固.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
2.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
7.已知:25℃,H2A的电离常数K1=6.0×10-2,K2=6.0×10-5,此温度下,将1mL浓度为0.1mL•L-1的H2A溶液加水稀释到1000mL,下列说法正确的是( )
| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |
17.下列有机物在核磁共振氢谱上有两组峰的是( )
| A. | 甲酸乙酯 | B. | 2-甲基丙烯酸乙酯 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 2-氯-2-甲基丙醛 |
4.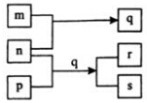 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小W<X<Z | B. | W的氧化物常温常压下为液态 | ||
| C. | Y的氧化物可能呈黑色或红棕色 | D. | Z的氧化物的水化物一定为强酸 |
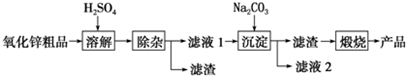
7.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如图:
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.
8.关于胶体,下列说法正确的是( )
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |

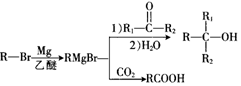
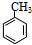 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$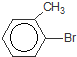 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应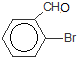
 ,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
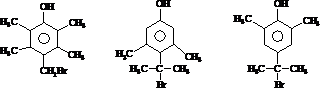
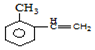 )的路线流程图(其他试剂任选)
)的路线流程图(其他试剂任选)