题目内容
16.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 某温度时pH=6的纯水中含有10-6NA个H+ | |
| B. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 在25℃、1.01×105Pa时,121gCF2Cl2所含的氯原子数为2NA | |
| D. | 常温下,5.6g铁投入到足量的浓硝酸中,反应转移的电子数为0.3NA |
分析 A.缺少水的体积,无法计算氢离子的物质的量;
B.二者的摩尔质量都是78g/mol,二者的化学式中都含有2个钠离子和1个阴离子;
C.根据n=$\frac{m}{M}$计算出121gCF2Cl2的物质的量,然后计算出含有的氯原子的物质的量及数目;
D.铁在浓硝酸中发生钝化,阻止的反应的继续进行.
解答 解:A.没有告诉水的体积,无法计算该纯水中氢离子的物质的量及数目,故A错误;
B.7.8gNa2S和Na2O2的混合物的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中的阴离子为过氧根离子,则0.1mol该混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故B错误;
C.121gCF2Cl2的物质的量为:$\frac{121g}{121g/mol}$=1mol,含有2mol氯原子,所含的氯原子数为2NA,故C正确;
D.常温下铁与浓硝酸发生钝化现象,阻止的反应进行,则无法计算转移的电子数,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系为解答关键,D为易错点,转移常温下铁与浓硫酸、浓硝酸发生钝化现象.

练习册系列答案
相关题目
7.下列关于极性键的叙述不正确的是( )
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
8.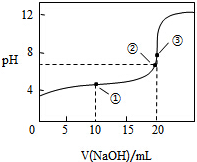 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )| A. | 点③溶液显碱性的原因是 CH3COO-+H2O═CH3COOH+OH- | |
| B. | 点②时溶液中c(Na+)大于c(CH3COO-) | |
| C. | 点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-) | |
| D. | 在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |
5.常温下,醋酸和氨水的电离平衡常数均为1.8×10-5.向10mL浓度为0.1mol•L-1的NH3•H2O溶液中滴加相同浓度的CH3COOH(温度变化忽略不计),在滴加过程中( )
| A. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$先增大再减小 | |
| B. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| C. | 水的电离程度始终增大 | |
| D. | 当加入CH3COOH的体积为10mL时,c(NH4+)=c(CH3COO-) |
 .
.
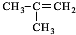 .
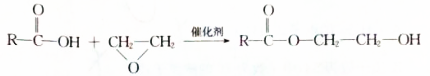
.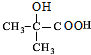 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$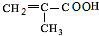 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.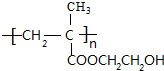 .
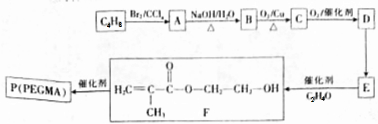
.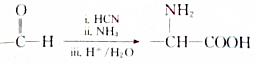 .设计由B合成
.设计由B合成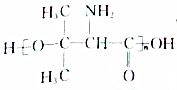 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
 ⑤
⑤ ⑧
⑧ ⑨
⑨ .
.