题目内容
9. 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu(1)基态铜原子的外围电子排布式为3d104s1,硫、氧元素相比,第一电离能较大的元素是O(填元素符号).
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是sp2,其立体结构是V形.
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液$\stackrel{氨水}{→}$蓝色沉淀$\stackrel{氨水}{→}$沉淀溶解,得到深蓝色透明溶液.写出蓝色沉淀溶于氨水的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;深蓝色透明溶液中的阳离子(不考虑H+ )内存在的全部化学键类型有共价键、配位键.
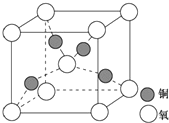
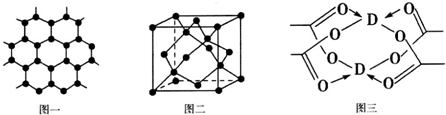
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为面心立方最密堆积;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{288}{a{N}_{A}}}$×1010pm.((用含d和NA的式子表示).
分析 (1)Cu处于的第四周期IB族;同主族自上而下第一电离能减小;
(2)反应①、②中均生成的气体分子为SO2,计算分子中S原子孤电子对,价层电子对数,确定杂化方式与立体结构;
(3)硫酸铜溶液与氨水生成氢氧化铜,氢氧化铜溶于过量的氨水生成[Cu(NH3)4]2+离子,[Cu(NH3)4]2+离子中存在共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积;
由均摊法计算晶胞中Cu原子和O原子的数目,表示出晶胞的质量,根据密度计算公式ρ=$\frac{m}{V}$计算出体积,进而计算晶胞的棱长,晶胞中心O原子与周围Cu原子形成正四面体结构,其连线处于晶胞体对角线上,二者距离为体对角线程度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍.
解答 解:(1)Cu位于第四周期IB族,基态铜原子的价电子排布式为3d104s1;同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;
故答案为:3d104s1;O;
(2)反应①②生成的相同气体分子是SO2,SO2中S原子的孤电子对数=$\frac{1}{2}$(6-2×2)=1,价层电子对数=2+1=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V形,
故答案为:sp2;V形;
(3)硫酸铜溶液与氨水生成氢氧化铜蓝色沉淀,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,蓝色沉淀溶于氨水的离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有共价键、配位键,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,
在铜的某种氧化物晶胞中,O原子在晶胞的顶点和体心,故O原子数=$\frac{1}{8}$×8+1=2,Cu原子全部在体心,故Cu原子数=4,则晶胞质量为$\frac{64×4+16×2}{{N}_{A}}$g,该晶体的密度为d g/cm3,则晶胞体积V=$\frac{64×4+16×2}{{N}_{A}}$g÷d g/cm3=$\frac{288}{d{N}_{A}}$cm3,所以晶胞的棱长为$\root{3}{\frac{288}{a{N}_{A}}}$cm,晶胞中心O原子与周围Cu原子形成正四面体结构,其连线处于晶胞体对角线上,二者距离为体对角线程度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,故晶胞中铜原子与氧原子之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{288}{a{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{288}{a{N}_{A}}}$×1010pm,
故答案为:面心立方最密堆积;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{288}{a{N}_{A}}}$×1010.
点评 本题考查物质结构和性质,涉及晶胞计算、配位键、核外电子排布、微粒空间构型判断等知识点,侧重考查学生计算及空间想象能力,难点是晶胞计算,关键是明确Cu、O原子之间的距离与棱长的关系.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2-3次 | |
| B. | 可使用酚酞或甲基橙作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准溶液的刻度时,滴定前平视,滴定后仰视,测定结果偏高 |
| A. | MgCl2 | B. | Na2O2 | C. | H2SO4 | D. | NaOH |
 2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验: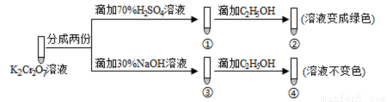
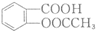 和
和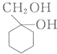 的流程路线.
的流程路线.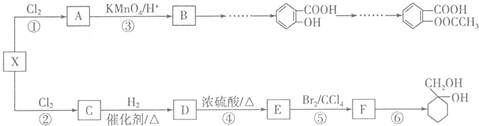
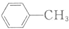 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$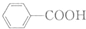
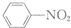 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$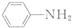 (苯胺,易被氧化)
(苯胺,易被氧化)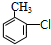 .
.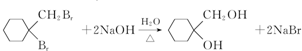 .
.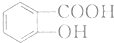 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式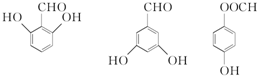 (任写一种).
(任写一种).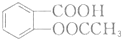 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.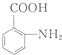 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.

 .
. .
.