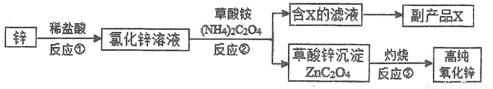
题目内容
15.工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3).其工业流程如图1: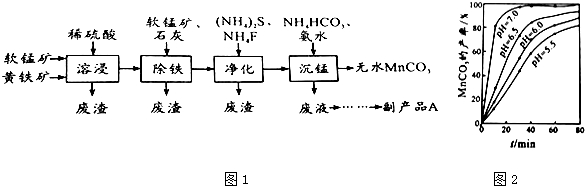
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解.回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol•L-1,滤液中残留的c(Ca2+)=1.46×10-6 mol/L〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示.根据图2中信息得出的结论是pH等于7.0时反应速率最快,且MnCO3的产率最高.
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥).
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应.
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+═Mn2++2CO2↑+2H2O
求该软锰矿中二氧化锰的质量分数72.5%(写出计算过程).
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸,FeS2和稀硫酸反应生成Fe2+,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,再加入软锰矿将Fe2+氧化为Fe3+,加入CaO调节溶液pH,将Fe3+转化为Fe(OH)3除去,再过滤分离,加入硫化铵和氟化铵,除去溶液中的Cu2+、Ca2+等杂质,再过滤分离,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到MnCO3,分液中主要含有(NH4)2SO4.
(1)根据Ksp(CaF2)=c2(F-)×c(Ca2+)计算;
(2)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;
(4)计算25mL溶液中剩余草酸钠消耗高锰酸钾物质的量,可得250mL溶液消耗高锰酸钾的物质的量,根据电子转移守恒计算二氧化锰的物质的量,进而计算样品中二氧化锰的质量分数.
解答 解:由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸,FeS2和稀硫酸反应生成Fe2+,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,再加入软锰矿将Fe2+氧化为Fe3+,加入CaO调节溶液pH,将Fe3+转化为Fe(OH)3除去,再过滤分离,加入硫化铵和氟化铵,除去溶液中的Cu2+、Ca2+等杂质,再过滤分离,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到MnCO3,分液中主要含有(NH4)2SO4.
(1)Ksp(CaF2)=1.46×10-10,c(F-)=0.01 mol•L-1,则c(Ca2+)=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$mol/L=1.46×10-6mol•L-1,
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×$\frac{250mL}{25mL}$=0.00400mol;
根据氧化还原反应中得失电子数相等得:n(MnO2)×2+0.00400mol×5=0.0200mol×2,
解得n(MnO2)=0.0100mol,
二氧化锰质量分数=$\frac{0.0100mol×87g/mol}{1.20g}$×100%=72.5%,
故答案为:72.5%.
点评 本题考查物质制备工艺流程,涉及溶度积常数计算、物质分离和提纯操作、图象分析、氧化还原反应滴定与计算等知识点,侧重考查学生分析理解能力与计算能力,需要学生具备扎实的基础.

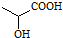 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
| A. | 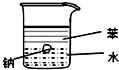 证明密度ρ(苯)<ρ(钠)<ρ(水) | B. | 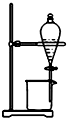 分离酒精和四氯化碳 | ||
| C. | 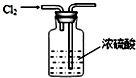 干燥Cl2 | D. | 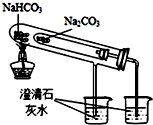 比较NaHCO3和Na2CO3的热稳定性 |
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| C. | Y、Z、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
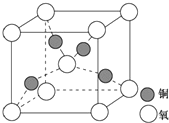 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu