题目内容
4.下列物质中含有的化学键既有离子键又有非极性共价键的是( )| A. | MgCl2 | B. | Na2O2 | C. | H2SO4 | D. | NaOH |
分析 一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性键,不同种非金属元素之间形成极性共价键,以此来解答.
解答 解:A.MgCl2中只含离子键,故A错误;
B.过氧化钠中钠离子和过氧根离子间存在离子键,过氧根离子中氧原子和氧原子之间存在非极性共价键,故B正确;
C.H2SO4中只含共价键,故C错误;
D.氢氧化钠中氢氧根离子和钠离子之间存在离子键,氧原子和氢原子之间存在极性共价键,故D错误;
故选B.
点评 本题考查化学键,明确离子键、共价键的成键规律即可解答,难度不大.

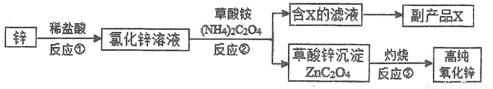
 名校课堂系列答案
名校课堂系列答案以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L?1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L?1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L?1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42?,含有Cu+、Cu2+和SO32?。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+ CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32?。
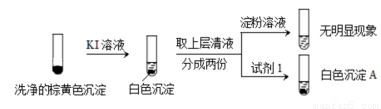
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32?的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42?,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
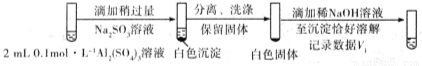
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.20mol•L-的盐酸来滴定待测液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol/L,烧碱样品的纯度是97.56%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果偏高
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果无影响.
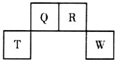 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
| A. | 汽车催化转化器中尾气处理反应的化学方程式为CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$C+NO2 | |
| B. | 铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42-、ClO- |


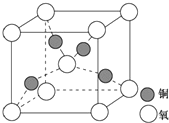 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu