题目内容
18.具有真正意义上的元素周期表是由哪位化学家发现的是( )| A. | 门捷列夫(俄国) | B. | 依马林(俄国) | ||
| C. | 别洛索夫(俄国) | D. | 马尔柯夫尼可夫(俄国) |
分析 1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.
解答 解:A.门捷列夫发现了元素周期律,并编制出具有真正意义上的元素周期表,使得化学学习和研究变得有规律可循,
故选A.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累,回顾历史,面向未来.

练习册系列答案
相关题目
13.在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
表中V2=40mL,该实验的目的是实验目的是探究温度、亚硫酸钠溶液浓度与该反应速率的关系.
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
3.在下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | NaCl+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4(浓) | D. | CuO+H2SO4(浓) |
10.欲除去下列物质中的杂质(括号内为杂质),所选用的方法不妥当的是( )
| A. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸,然后加热 | |
| B. | 碳酸钠固体(碳酸氢钠):加热至恒重 | |
| C. | FeCl2溶液(FeCl3、CuCl2):加入过量Fe粉充分搅拌,然后过滤 | |
| D. | 乙醇(水):加入新制的生石灰,然后蒸馏 |
7. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
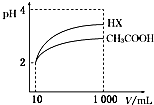
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
8.五种元素X、Y、Z、W、M在周期表中位置关系如表,其中X、Y、Z、W是短周期元素,Z的气态氢化物与其低价氧化物能反应生成该元素单质的元素.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |