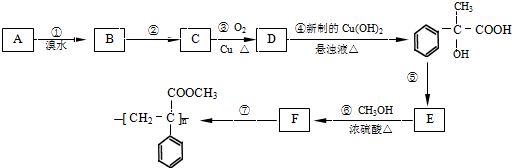
题目内容
NA代表阿伏加德罗常数值,下列说法正确的是( )
| A、32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0NA |
| B、1.4g乙烯和丙烯的混合物中含原子数为0.3NA |
| C、常温常压下,11.2L乙烷所含分子数小于0.5NA |
| D、2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、铜与硫单质反应生成硫化亚铜,32g铜的物质的量为0.5mol,完全反应失去0.5mol电子;
B、乙烯和丙烯的最简式都是CH2,利用n=
来计算;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、常温下,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,氯气既是氧化剂又是还原剂.
B、乙烯和丙烯的最简式都是CH2,利用n=
| m |
| M |
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、常温下,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,氯气既是氧化剂又是还原剂.
解答:
解:A、32g铜的物质的量为0.5mol,0.5mol铜与S完全反应失去0.5mol电子,电子转移总数为0.5NA,故A错误;
B、乙烯和丙烯的最简式都是CH2,CH2的物质的量为
=0.1mol,则混合物中含碳原子数为0.1×1×NA=0.1NA,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L乙烷的物质的量小于0.5mol,故C正确;
D、由Cl2+2NaOH═NaCl+NaClO+H2O,标准状况下氯气的物质的量为
=0.1mol,氯气既是氧化剂又是还原剂,则转移的电子数为0.1NA,故D错误;
故选C.
B、乙烯和丙烯的最简式都是CH2,CH2的物质的量为
| 1.4g |
| 14g/mol |
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L乙烷的物质的量小于0.5mol,故C正确;
D、由Cl2+2NaOH═NaCl+NaClO+H2O,标准状况下氯气的物质的量为
| 2.24L |
| 22.4L/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+.下列说法不正确的是( )
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应方程式为:C2H5OH+3H2O-12e-=2CO2+12H+.下列说法不正确的是( )| A、C1极为电池负极,C2极为电池正极 |
| B、C2极的电极反应式为O2+4H++4e-=2H2O |
| C、该生物燃料电池的总反应方程式为C2H5OH+3O2=2CO2+3H2O |
| D、电子由C2极经外电路导线流向C1极 |
下列排列顺序正确的是( )
| A、常温下水电离出的c(H+):pH=5的CH3COOH溶液>pH=5的盐酸 |
| B、微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C、等温等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3 |
| D、氢化物的沸点:H2Se>H2S>H2O |
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
| A、0.04mol/L |
| B、0.2mol/L |
| C、1mol/L |
| D、2m01/L |
设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、2.4g金属镁所含电子数目为0.2NA |
| B、1摩尔CH4所含质子数目为10NA |
| C、标准状况下22.4LH2O所含分子数目为NA |
| D、18gNH4+所含电子数目为10 NA |
下列化学用语表达正确的是( )
| A、碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |
| B、碳酸钙的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
| C、氯化铝发生水解的离子方程式:Al3++3H2O═Al(OH)3+3H+ |
| D、亚硫酸的电离方程式:H2SO3?2H++SO32- |
下列物质的化学用语正确的是( )
①NH4H的电子式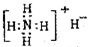
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
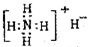
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |