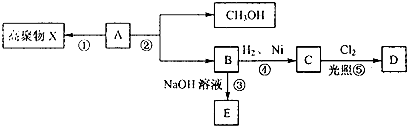
题目内容
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
| A、0.04mol/L |
| B、0.2mol/L |
| C、1mol/L |
| D、2m01/L |
考点:物质的量浓度的相关计算
专题:
分析:根据n=
计算2g NaOH的物质的量,再根据c=
计算所得NaOH溶液物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:2g NaOH的物质的量为
=0.05mol,溶于水配成250mL溶液,所得NaOH溶液物质的量浓度为
=0.2mol/L,故选B.
| 2g |
| 40g/mol |
| 0.05mol |
| 0.25L |
点评:本题考查物质的量浓度的计算,比较基础,注意对公式的理解与灵活应用,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质稀溶液混合,再加入适量硫酸静置后,颜色没有明显变化的是( )
| A、酚酞溶液、NaOH、KNO3 |
| B、品红溶液、Na2SO3、KCl |
| C、Mg(NO3)2、NaNO3、CuSO4 |
| D、FeCl2、KSCN、NaNO3 |
氯气与二氧化硫都具有漂白作用,能使品红溶液褪色;若将等物质的量的氯气与二氧化硫混合后分别通入品红和氯化钡溶液中,能观察到的现象是( )
| A、溶液褪色、不生成沉淀 |
| B、溶液不褪色、生成沉淀 |
| C、溶液褪色、生成沉淀 |
| D、溶液不褪色、不生成沉淀 |
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为34,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数; A与C,B与D均为同主族元素.下列叙述正确的是( )
| A、B、D的最高价氧化物都不能和酸反应 |
| B、最高价氧化物对应的水化物的碱性:A>C |
| C、A的原子半径为这四种当中最小的 |
| D、四种元素中B形成化合物的种类最多 |
NA代表阿伏加德罗常数值,下列说法正确的是( )
| A、32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0NA |
| B、1.4g乙烯和丙烯的混合物中含原子数为0.3NA |
| C、常温常压下,11.2L乙烷所含分子数小于0.5NA |
| D、2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2NA |
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表: