题目内容
12.现有下列四个图象:
下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
分析 由前两个图象可知,温度越高生成物的浓度越高,则正反应为吸热反应,由后两个图象可知,压强越大,平均相对分子质量越大,且平衡后加压逆反应速率大于正反应速率,则加压化学平衡逆向移动,即化学反应方程式中逆向是气体体积减小的方向,然后依据此两点来分析反应.
解答 解:A、该反应中化学计量数1+3>2,△H<0,正反应为放热反应,加压化学平衡正向移动,与图象不符合,故A错误;
B、该反应中化学计量数2<2+1,△H>0,该反应为吸热反应,加压化学平衡逆向移动,与图象相符,故B正确;
C、该反应中化学计量数4+5<4+6,△H<0,符合正反应为放热反应,加压化学平衡逆向移动,与图象不符,故C错误;
D、该反应中化学计量数2>1,△H>0,加压化学平衡正向移动,该反应为吸热反应,与图象不符,故D错误;
故选B.
点评 本题考查化学反应速率和化学平衡的图象,明确温度、压强对化学反应速率及化学平衡的影响是解答本题的关键,并熟悉图橡中坐标的含义及“定一议二”来分析解答即可.

练习册系列答案
相关题目
2.下列原子中未成对电子(单独占据1个原子轨道的电子)数为2的是( )
| A. | O | B. | N | C. | Cu | D. | F |
20.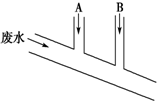 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
17.下列离子方程式,一定不正确的是.( )
| A. | 实验室用石灰石和盐酸反应制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液反应:HCO3-+Ba2++OH-═BaCO3↓+H2O |
4.电镀工业会产生大量的电镀污水,处理电镀污水时会产生大量的电镀污泥.电镀污泥含.有多种金属氢氧化物和杂质.下面是处理某种电镀污泥回收铜、镍元素的一种工业流程.
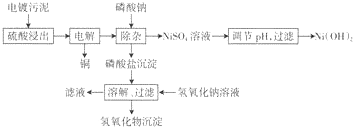
电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表.
(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有加热、增大硫酸浓度、搅拌(写出两条).
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为FePO4、CrPO4、AlPO4.
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中P043-浓度不能超过$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$mol.L-l.(列出计算表达式,Ksp[Ni3(P04)2]=5xl0-31)
(4)滤液中的Na3PO4可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为Al(OH)3+OH-=AlO2-+2H2O(用离子方程式解释).
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀.写出加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀的离子方程式xCr3++Fe2++(2-x)Fe3++8OH-=CrxFe3-xO4↓+4H2O.

电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表.
| 金属离子 | Cu3+ | Ni3+ | Fe3+ | Al3+ | Cr3+ |
| 浓度(mg/L) | 7000 | 7000 | 2500 | 4200 | 3500 |
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为FePO4、CrPO4、AlPO4.
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中P043-浓度不能超过$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$mol.L-l.(列出计算表达式,Ksp[Ni3(P04)2]=5xl0-31)
(4)滤液中的Na3PO4可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为Al(OH)3+OH-=AlO2-+2H2O(用离子方程式解释).
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀.写出加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀的离子方程式xCr3++Fe2++(2-x)Fe3++8OH-=CrxFe3-xO4↓+4H2O.
1.有一块铝铁合金溶于足量盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧后,剩余固体粉末的质量与原合金质量恰好相等,则合金中铝的含量为( )
| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |