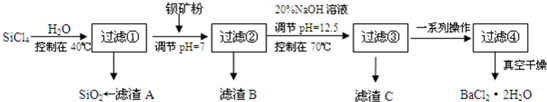
题目内容
1.有一块铝铁合金溶于足量盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧后,剩余固体粉末的质量与原合金质量恰好相等,则合金中铝的含量为( )| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |
分析 铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.
解答 解:由铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,则合金中Al的质量分数等于氧化铁中氧的质量分数=$\frac{16×3}{160}$×100%=30%,
故选A.
点评 本题考查混合物的有关计算,难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
12.现有下列四个图象:

下列反应中全部符合上述图象的反应是( )

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
16.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,H2,CH4 | B. | PCl5,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
6.某烃的结构简式为 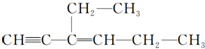 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
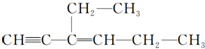 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )| A. | 4、5、3 | B. | 4、6、3 | C. | 2、4、5 | D. | 4、4、6 |
13.下列变化克服的是分子间作用力的是( )
| A. | 氯化钠晶体熔化 | B. | 电解水 | ||
| C. | 碘升华 | D. | 硫化氢受热分解为氢气和硫 |
10.下列关于煤的干馏的叙述中,正确的是( )
| A. | 煤加强热而分解的过程叫做煤的干馏 | |
| B. | 煤干馏的目的是得到冶金用的优质焦炭 | |
| C. | 煤的干馏和石油的分馏的本质差别是:干馏是化学变化,而分馏是物理变化 | |
| D. | 工业上芳香烃原料可由煤干馏得到,其存在于干馏所得的焦炉气中 |
11.下列化学反应中的说法错误的是( )
| A. | 化学反应中有物质变化也有能量变化 | |
| B. | 化学键断裂吸收能量,化学键生成放出能量 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 图所示的反应为放热反应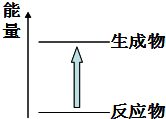 |