题目内容
7.用质量分数为98%的浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀 回答下列问题
(1)若所用浓硫酸密度为1.84g/cm3,则该浓硫酸的物质的量浓度为18.4 mol/L,配制上述稀硫酸所需浓硫酸的体积是16.3(小数点后保留一位)
(2)为了保证实验的准确性,在第③和第④步操作之间还应该加多一步什么操作冷却.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据配制溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等解答.
解答 解:(1)密度为1.84g/mL、质量分数为98%的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=100mL×3.0mol/L,解得V=16.3mL;
故答案为:18.4mol/L;16.3;
(2)依据配制溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀可知在第③和第④步操作之间还应该加多一步冷却;
故答案为:冷却.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉有关物质的量浓度计算公式、溶液稀释的规律是解题关键,注意容量瓶在标定温度下测定的体积才准确,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
18.下列叙述中,正确的是( )
| A. | 1mol 过氧化钠中阴离子个数为2×6.02×1023 | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 | |
| C. | 28g C16O与28g C18O中含有的质子数均为14×6.02×1023 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
15.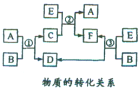 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
(1)若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为I2<Br2<Cl2(写化学式).在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式:5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(2)若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如表所示(x和y均大于0).
各离子的量与E的体积的关系
I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
Ⅱ.x=0.15,y=0.9(填具体数据).
Ⅲ.当通入E的体积为11.2L时,该溶液中c(Na+)=2.9mol•L-1(通入E后溶液的体积变化忽略不计).
 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.(1)若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为I2<Br2<Cl2(写化学式).在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式:5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(2)若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如表所示(x和y均大于0).
各离子的量与E的体积的关系
| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
Ⅱ.x=0.15,y=0.9(填具体数据).
Ⅲ.当通入E的体积为11.2L时,该溶液中c(Na+)=2.9mol•L-1(通入E后溶液的体积变化忽略不计).
2.我军于2013年9月10-28日举行代号为“使命行动-2013”被称为“近十年世界罕见”的军事演习.在这次演习中,我军使用的新型战机是用纳米材料制造飞机的蒙皮,这样可以灵敏“感知”各种主动式探测信号.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料.如将纳米材料分散到液体分散剂中所得混合物可能具有的性质是( )
| A. | 能全部透过半透膜 | B. | 所得物质一定是浊液 | ||
| C. | 所得物质属于纯净物 | D. | 有丁达尔效应 |
12.现有下列四个图象:

下列反应中全部符合上述图象的反应是( )

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
16.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,H2,CH4 | B. | PCl5,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
17.下列物质中,属于电解质的是( )
| A. | 铜 | B. | 氯化钠溶液 | C. | 酒精 | D. | 烧碱 |