题目内容
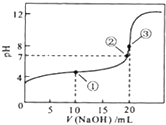 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
B、根据滴定过程酸过量来分析;
C、根据滴定终点的判断方法;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则醋酸过量.
B、根据滴定过程酸过量来分析;
C、根据滴定终点的判断方法;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则醋酸过量.
解答:
解:A、NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,故A正确;
B、滴定过程酸过量时,c(Cl-)>c(H+)>c(Na+)>c(OH-),故B错误;
C、用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,停止滴定,故C错误;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,所以滴定到pH=7时,a<20.00,故D错误;
故选A.
B、滴定过程酸过量时,c(Cl-)>c(H+)>c(Na+)>c(OH-),故B错误;
C、用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,停止滴定,故C错误;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,所以滴定到pH=7时,a<20.00,故D错误;
故选A.
点评:本题考查了常见的实验操作,注意过程的分析,难度不大,应注意相关知识的积累.

练习册系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )


| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3、NaOH、BaCl2和盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在第③④⑤步中溴元素均被氧化 |
| D、由海水提取的金属镁能与金属铝、氢氧化钠溶液在一定条件下形成原电池,金属镁作该原电池正极 |
下列各组物质中属于同分异构体的是( )
| A、金刚石和C60 |
B、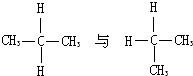 |
C、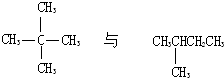 |
| D、CH4与CH3CH3 |
常温下,取0.1 mol?L-1HY溶液与0.1 mol?L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是( )
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3-、Cl- |
| B、由水电离出的c(H+)=1×10-11 mol?L-1溶液:Na+、Mg2+、Cl-、NO3- |
| C、0.2 mol?L-1的NaNO3溶液:H+、Fe2+、SO42-、Cl- |
| D、与Fe反应生成H2的溶液:NH4+、K+、SO42-、CO32- |
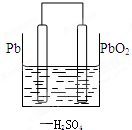 (1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为
(1)铅蓄电池在生产生活中有广泛的应用,其工作原理为总方程式:Pb+PbO2+2H2SO4═2PbSO4+2H2O,其中负极为