题目内容
下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3-、Cl- |
| B、由水电离出的c(H+)=1×10-11 mol?L-1溶液:Na+、Mg2+、Cl-、NO3- |
| C、0.2 mol?L-1的NaNO3溶液:H+、Fe2+、SO42-、Cl- |
| D、与Fe反应生成H2的溶液:NH4+、K+、SO42-、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:A.能使甲基橙呈红色的溶液呈酸性;
B.由水电离出的c(H+)=1×10-11 mol?L-1溶液,溶液可能呈酸性也可能呈碱性;
C.NO3-在酸性条件下具有强氧化性;
D.与Fe反应生成H2的溶液呈酸性.
B.由水电离出的c(H+)=1×10-11 mol?L-1溶液,溶液可能呈酸性也可能呈碱性;
C.NO3-在酸性条件下具有强氧化性;
D.与Fe反应生成H2的溶液呈酸性.
解答:
解:A.使甲基橙呈红色的溶液显酸性,离子均能共存,故A正确;
B.由水电离出c(H+)=1×10-11 mol?L-1,溶液可能呈酸性也可能呈碱性,Mg2+在碱性条件下不能共存,故B错误;
C.NO3-、H+和Fe2+在溶液中发生氧化还原反应,故C错误;
D.酸性溶液与Fe反应生成H2,溶液中H+与CO32-不能共存,故D错误.
故选A.
B.由水电离出c(H+)=1×10-11 mol?L-1,溶液可能呈酸性也可能呈碱性,Mg2+在碱性条件下不能共存,故B错误;
C.NO3-、H+和Fe2+在溶液中发生氧化还原反应,故C错误;
D.酸性溶液与Fe反应生成H2,溶液中H+与CO32-不能共存,故D错误.
故选A.
点评:本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力和综合应用化学知识的能力的考查,注意把握离子的性质以及反应类型的判断,注意把握题给信息,易错点为C,注意硝酸的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
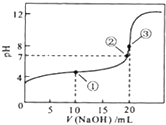 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是( )
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
烧过菜的铁锅未及时洗涤,会出现红棕色锈斑.整个过程不可能发生的变化为( )
| A、2H2O+O2+4e-═4OH- |
| B、Fe-3e-═Fe3+ |
| C、Fe2++2OH-═Fe(OH)2 |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |




 盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )
盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )