题目内容
常温下,取0.1 mol?L-1HY溶液与0.1 mol?L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是( )
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下,等浓度、等体积的HY和NaOH恰好反应生成NaY,溶液呈碱性,说明NaY是强碱弱酸盐;根据电荷守恒、质子守恒、物料守恒可知A、B、D是正确的;再根据电荷守恒判断C,正确关系应该为:c(Na+)>c(Y-).
解答:
解:等浓度、等体积的HY与NaOH溶液混合恰好反应生成NaY,溶液pH=9,显示碱性,则说明NaY为强碱弱酸盐,HY为弱酸,
A.混合液中一定满足物料守恒,根据物料守恒可得:c(Na+)═c(Y-)+c(HY),故A正确;
B.混合液中一定满足质子守恒,根据质子守恒恒可知:c(OH-)═c(H+)+c(HY),故B正确;
C.溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),盐是强电解质,完全电离,水的电离程度较小,所以c(Y-)>c(OH-),则溶液中离子浓度由大到小的顺序为 c(Na+)>c(Y-)>c(OH-)>c(H+),故C错误;
D.溶液中一定满足电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)=c(Y-)+c(OH-),故D正确;
故选C.
A.混合液中一定满足物料守恒,根据物料守恒可得:c(Na+)═c(Y-)+c(HY),故A正确;
B.混合液中一定满足质子守恒,根据质子守恒恒可知:c(OH-)═c(H+)+c(HY),故B正确;
C.溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),盐是强电解质,完全电离,水的电离程度较小,所以c(Y-)>c(OH-),则溶液中离子浓度由大到小的顺序为 c(Na+)>c(Y-)>c(OH-)>c(H+),故C错误;
D.溶液中一定满足电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)=c(Y-)+c(OH-),故D正确;
故选C.
点评:本题考查了酸碱混合溶液定性判断、溶液中离子浓度大小比较,题目难度中等,根据混合溶液酸碱性确定HY的强弱,再结合电荷守恒、物料守恒来分析.

练习册系列答案
相关题目
 如图:是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )
如图:是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )| A、电石和水 |
| B、MnO2和浓盐酸 |
| C、Cu片和浓硝酸 |
| D、Na2SO3(s)和浓硫酸 |
CO2转化成有机物实现碳循环,是解决温室效应的有效途径之一,此反应化学平衡常数的表达式为:K=
且温度升高,K值变小.下列说法正确的是( )
| c(CH3OH).c(H2O) |
| c3(H2).c(CO2) |
| A、该反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H>O |
| B、在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态 |
| C、在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大 |
| D、平衡时,其他条件不变,使用催化剂有利用于CO2的转化 |
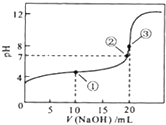 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
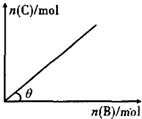 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
下列说法正确的是( )
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
根据有关的概念,推断下列说法中正确的是( )
| A、元素的非金属性越强,单质的活泼性一定越强 |
| B、分子晶体中分子间的作用力越大,分子越稳定 |
| C、离子晶体发生状态变化时,一定会破坏离子键 |
| D、分子中含有两个氢原子的酸,一定就是二元酸 |
