题目内容
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01mol?L-1(填“>”、“<”或“=”).
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
(4)在25℃下,向浓度均为0.20mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
(2)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
(4)在25℃下,向浓度均为0.20mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
考点:溶液的配制,难溶电解质的溶解平衡及沉淀转化的本质,中和滴定
专题:实验题,计算题
分析:(1)(1)AgNO3中的银离子在水中易水解,而显酸性,为了抑制其水解要加硝酸;
(2)根据电荷守恒、溶液呈中性判断离子浓度大小;氨水若和盐酸恰好完全反应,生成的产物氯化铵溶液呈酸性,所以中性时氨水应过量;
(3)根据c=
,看是哪一个物理量影响产生的误差;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,当溶液中C(Cu2+)=10-5 mol/L时,认为铜离子完全沉淀,再根据氢氧化镁溶度积常数、pH计算c(Mg2+).
(2)根据电荷守恒、溶液呈中性判断离子浓度大小;氨水若和盐酸恰好完全反应,生成的产物氯化铵溶液呈酸性,所以中性时氨水应过量;
(3)根据c=
| n |
| v |
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,当溶液中C(Cu2+)=10-5 mol/L时,认为铜离子完全沉淀,再根据氢氧化镁溶度积常数、pH计算c(Mg2+).
解答:
解::(1)AgNO3中的银离子在水中易水解,而显酸性,水解方程式为:Ag++H2O?AgOH+H+,为了抑制其水解,配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
故答案为:Ag++H2O AgOH+H+;抑制;
AgOH+H+;抑制;
(2)氨水和盐酸反应生成氯化铵和水,故溶液中存在的离子有:OH-、H+、NH4+、Cl-;溶液中存在电荷守恒,根据电荷守恒得n(NH4+)+n(H+)=n(OH-)+n(Cl-),溶液呈中性,即n(H+)=n(OH-),所以离子浓度大小关系为:c(Cl-)=c(NH4+)>c(H+)=c(OH-);氨水若和盐酸恰好完全反应,生成的产物氯化铵溶液呈酸性,所以中性时氨水应过量,即浓度大于0.01mol/L;
故答案为:OH-、H+、NH4+、Cl-;c(Cl-)=c(NH4+)>c(H+)=c(OH-);>;
(3)A、未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,可知c(酸)偏高,故A正确.
B、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,这一滴标准液没有参加反应,又计算在了标准液中,会导致测定结果偏高,故B正确;
C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,不会影响测定结果,故C错误
D、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,测定结果偏低,故D错误;
故答案为:AB;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,溶液pH=11,则溶液中c(OH-)=0.001mol/L,再根据溶度积常数得c(Mg2+)=
mol/L=1.8×10-5mol/L,c(Cu2+)=
mol/L=2.0×10-14mol/L,所以c(Mg2+):c(Cu2+)=1.8×10-5mol/L:2.0×10-14mol/L=9.0×108,
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;9.0×108.
故答案为:Ag++H2O
 AgOH+H+;抑制;
AgOH+H+;抑制;(2)氨水和盐酸反应生成氯化铵和水,故溶液中存在的离子有:OH-、H+、NH4+、Cl-;溶液中存在电荷守恒,根据电荷守恒得n(NH4+)+n(H+)=n(OH-)+n(Cl-),溶液呈中性,即n(H+)=n(OH-),所以离子浓度大小关系为:c(Cl-)=c(NH4+)>c(H+)=c(OH-);氨水若和盐酸恰好完全反应,生成的产物氯化铵溶液呈酸性,所以中性时氨水应过量,即浓度大于0.01mol/L;
故答案为:OH-、H+、NH4+、Cl-;c(Cl-)=c(NH4+)>c(H+)=c(OH-);>;
(3)A、未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,可知c(酸)偏高,故A正确.
B、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,这一滴标准液没有参加反应,又计算在了标准液中,会导致测定结果偏高,故B正确;
C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,不会影响测定结果,故C错误
D、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,测定结果偏低,故D错误;
故答案为:AB;
(4)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Cu(OH)2先生成沉淀,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,溶液pH=11,则溶液中c(OH-)=0.001mol/L,再根据溶度积常数得c(Mg2+)=
| 1.8×10-11 |
| 0.0012 |
| 2.0×10-20 |
| (10-3 )2 |
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;9.0×108.
点评:本题考查的内容综合性很强,考查了溶液的配制、滴定操作等内容,难度较大,注意认真审题.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
某烯烃和炔烃的混合气体,将1L混合气体燃烧,在同温同压下得到2.5L CO2气体.则该混合烃可能是( )
| A、C2H4和C2H2 |
| B、C2H4和C3H6 |
| C、C3H6和C2H2 |
| D、C3H6和C3H4 |
已知空气-锌电池的电极反应:锌片:Zn-2OH--2e-═ZnO+H2O,石墨:
O2+H2O+2e-═2OH-据次推断锌片是( )
| 1 |
| 2 |
| A、负极,被氧化 |
| B、负极,被还原 |
| C、正极,被氧化 |
| D、正极,被还原 |
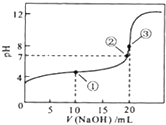 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液,滴定曲线如图所示,下列说法正确的是( )| A、a=20.0 |
| B、滴定过程中,不可能存在:c(Cl-)>c(H)+>c(Na+)>c(OH-) |
| C、若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 |
| D、若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a>20.00 |
下列说法正确的是( )
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
-定条件下,2SO2(g)+O2(g)?2SO2(g)△H<0.下列有关叙述正确的是( )
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是( )
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
烧过菜的铁锅未及时洗涤,会出现红棕色锈斑.整个过程不可能发生的变化为( )
| A、2H2O+O2+4e-═4OH- |
| B、Fe-3e-═Fe3+ |
| C、Fe2++2OH-═Fe(OH)2 |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |