题目内容
7.根据热化学方程式:S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1(Q>0),则下列分析正确的是( )| A. | 1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量 | |
| C. | S(s)+O2(g)═SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个 S(g) 与1个 O2(g)完全反应可放出 Q kJ的能量 |
分析 A、反应放热,反应物能量高;
B、热化学方程式的化学计量数只表示物质的量;
C、固态硫的能量低于硫蒸汽;
D、热化学方程式的化学计量数表示物质的量.
解答 解:A、△H<0,反应放热,反应物能量高,即1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量高Q kJ,故A错误;
B、热化学方程式的化学计量数表示物质的量,故1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量,故B正确;
C、固态硫的能量低于硫蒸汽,故1mol S(s) 与1mol O2(g)反应生成1mol SO2(g)放出的能量小于Q kJ,故△H>-Q kJ•mol-1,故C错误;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数,故D错误.
故选B.
点评 本题考查对热化学方程式的理解,特别是其化学计量数只表示物质的量.题目难度不大.

练习册系列答案
相关题目
17.常温下,下列各组离子在溶液中一定能大量共存的是( )
| A. | Fe3+、NO3-、SO42-、Na+ | B. | Ca2+、H+、Cl-、HCO3- | ||
| C. | NH4+、Al3+、NO3-、OH- | D. | Ba2+、ClO-、SO42-、SCN- |
18.研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)已知石墨的标准燃烧热为y kJ•mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1.
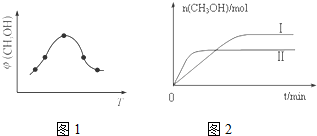
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H<(填“>”“<”或“=”)0.
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为0.4<n(c)≤1mol.
(1)已知石墨的标准燃烧热为y kJ•mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-(20x-y)kJ•mol-1.

(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{C(CH{\;}_{3}OH)C(H{\;}_{2}O)}{C(CO{\;}_{2})C{\;}^{3}(H{\;}_{2})}$.
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的△H<(填“>”“<”或“=”)0.
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
15.在100ml 0.5mol/L的CuCl2溶液中含有Cl-的数目为( )
| A. | 6.02×1023 | B. | 6.02×1022 | C. | 6.02×1021 | D. | 6.02×1020 |
2.下列各组物质中,互为同素异形体的是( )
| A. | 甲烷和乙烷 | B. | 丙烯和环丙烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
12.下列物质中属于强电解质,但在给定条件下不能导电的是( )
| A. | 液态溴化氢 | B. | 蔗糖 | C. | 铝 | D. | 醋酸 |
12.下列图①~④分别与相应的操作过程相对应,其中正确的是( )
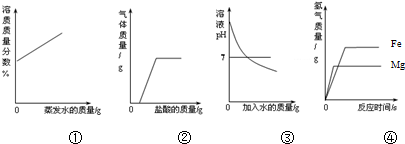

| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |