题目内容
12.下列图①~④分别与相应的操作过程相对应,其中正确的是( )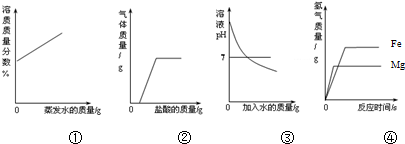
| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
分析 A.饱和溶液恒温蒸发水分,剩余溶液还是这一温度下的饱和溶液;
B.变质的氢氧化钠溶液含有氢氧化钠和碳酸钠,加盐酸会分别发生反应;
C.氢氧化钠溶液显碱性,pH大于7,加水时碱性不断变弱,但pH值不会小于7;
D.金属与酸反应,金属过量,生成的氢气的量与盐酸的量有关.
解答 解:A.饱和溶液恒温蒸发水分,剩余溶液还是这一温度下的饱和溶液,同一物质相同温度下的饱和溶液溶质质量分数是相等的,故溶质质量分数的曲线应该是直线,故A错误;
B.变质的氢氧化钠溶液含有氢氧化钠和碳酸钠,加盐酸会先与氢氧化钠反应,不会生成气体,后与碳酸钠反应生成二氧化碳反应直至碳酸钠耗尽,故B正确;
C.氢氧化钠溶液显碱性,pH大于7,加水时碱性不断变弱,但其始终显碱性,pH始终大于7,故C错误;
D.金属与酸反应是氢气是来源于酸中的氢元素,因为两种金属过量,则酸会全部消耗,因为酸量相等,故生成氢气相等,故D错误.
故选B.
点评 本题考查了饱和溶液的质量分数、元素化合物的性质等题目难度不大,解题关键是如何分析相关的化学过程并读懂图象分析图象.

练习册系列答案
相关题目
7.根据热化学方程式:S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1(Q>0),则下列分析正确的是( )
| A. | 1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量 | |
| C. | S(s)+O2(g)═SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个 S(g) 与1个 O2(g)完全反应可放出 Q kJ的能量 |
20.公共场所安放的“可回收垃圾”和“不可回收垃圾”两类垃圾箱,其中可以回收的垃圾,如:废弃的旧铜丝、废钢铁、铝制易拉罐等,根据物质的分类它们属于( )
| A. | 有毒的 | B. | 单质 | C. | 氧化物 | D. | 金属或合金 |
7.下列说法正确的是( )
| A. | 用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 将钢闸门与电源正极相连,可防止其在海水中被腐蚀 | |
| D. | 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同 |
17.下列各组名词或现象中,两者间没有逐级因果关系的是( )
| A. | 汽车尾气的大量排放--光化学污染 | |
| B. | 含磷洗衣粉的大量使用--水体富营养化 | |
| C. | 生活污水任意排放--CO2浓度增大 | |
| D. | 氟氯烃的大量使用--臭氧空洞 |
4.在U形管中用惰性电极电解硫酸钠和石蕊的混合液,一段时间后,可以观察到的现象是( )
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
2.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的是( )
| A. | 称量的NaOH固体已经潮解 | |
| B. | 洗涤后的容量瓶中留有少量蒸馏水 | |
| C. | 转移溶解液时,溶解液未冷却至室温 | |
| D. | 定容时俯视容量瓶的刻度线 |